Молекули речовин не всі прямі, ніби вони знаходяться в одній площині. Зрештою, вони розсіяні в просторі, і їхні атоми набувають різного розташування чи розташування. Таким чином, для молекул кожного типу речовини існують різні геометричні фігури.
Один з найпростіших способів визначення геометрії молекули заснований на теорії відштовхування електронних пар валентної оболонки (RPECV). Відповідно до цієї теорії електронні пари центрального атома функціонують як електронні хмари що відштовхуються один від одного. Таким чином вони орієнтуються якомога далі один від одного. Геометрія молекули буде залежати від кількості електронних пар навколо центрального атома.
Ця електронна хмара може складатися з електронів, які беруть участь у зв’язках (одинарних, подвійних або потрійних), а також не беруть участі. Отже, маємо:
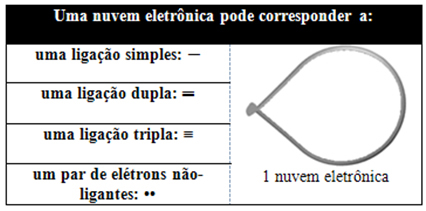
Допомагає думати про цю хмару як про прив’язану повітряну кулю або повітряні кулі з центральним атомом у центрі. Наприклад, у молекулі, яка має лише дві електронні хмари навколо центрального атома, тим більше можлива відстань між ними становить кут 180º і, отже, геометрія молекули буде лінійний.
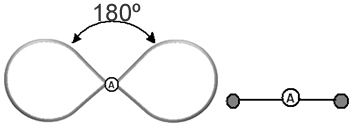
Отже, ми можемо зробити висновок про те, якою буде молекулярна геометрія більшості молекул, якщо взяти до уваги кількість атомів у молекулах і зв’язки, які створює центральний атом, перевіряючи, чи є у нього пари електрони.
Дивіться приклади нижче:
- Молекули з 2 атомами: завжди будуть лінійний
Наприклад:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
- 3-атомна молекула: кутова або трикутна
якщо центральний атом мають пару електронів, що не зв'язуються геометрія буде кутовий, як у випадку з молекулою SO2:
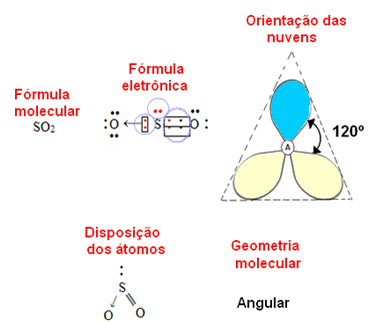
Вважайте, що блакитна електронна хмара позначає пари електронів, які не беруть участь у зв’язках, а жовта — пари електронів, які беруть участь у зв’язках.
- 4-атомна молекула: площина трикутна (або трикутна) або пірамідальна (або трикутна піраміда)
Якщо центральний атом не має неспареної (не зв’язуючої) електронної пари, геометрія молекули є плоскою тригональною (або трикутною). Подивіться на приклад BF3:

Якщо атом має електронні пари, що не зв’язуються, геометрія молекули буде пірамідальною (або тригональною пірамідою), як у випадку аміаку:

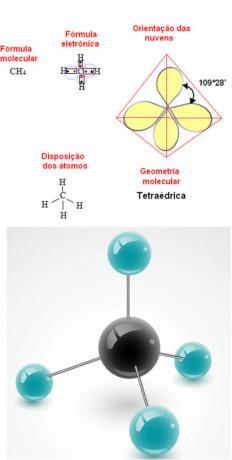
- 5-атомна молекула: тетраедричний
Приклад геометрії метану:
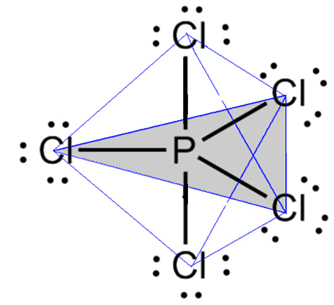
- Молекула з 6 атомами: трикутна біпіраміда або трикутна піраміда.
Прикладом є пентахлорид фосфору (PCl5), який має деякі з'єднання між фосфором і хлором під кутом 90º, а інші - 120º, утворюючи біпіраміду з трикутною основою:
- 7-атомна молекула: октаедричний
Приклад: гексафторид сірки (SF6), кути якого становлять 90º.

Автор: Дженніфер Фогаса
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm
