Французький хімік Анрі Луї Ле Шательє створив один із найвідоміших законів хімії, який передбачає реакцію хімічної системи в рівновазі під впливом змін.
За результатами своїх досліджень він сформулював узагальнення для хімічної рівноваги, яке стверджує наступне:
"Коли зовнішній фактор діє на систему в рівновазі, він рухається, завжди в сенсі мінімізації дії застосованого фактора".
Коли рівновага хімічної системи порушується, система діє, щоб мінімізувати ці порушення і відновити стабільність.
Тому система представляє:
- початковий стан рівноваги.
- «неврівноважений» стан із зміною фактора.
- новий стан рівноваги, який протистоїть змінам.
Прикладами зовнішніх порушень, які можуть вплинути на хімічний баланс, є:
| Фактор | Порушення | Це зроблено |
|---|---|---|
| Концентрація | Збільшувати | Вживати речовину |
| Зменшення | речовина виробляється | |
| Тиск | Збільшувати | Переходить до найменшого обсягу |
| Зменшення | Переходить до найбільшої гучності | |
| Температура | Збільшувати | Поглинає тепло і змінює константу рівноваги |
| Зменшення | Виділяє тепло і змінює константу рівноваги | |
| Каталізатор | Присутність | Реакція прискорюється |
Цей принцип має велике значення для хімічної промисловості, оскільки реакціями можна маніпулювати та зробити процеси більш ефективними та економічними.
Прикладом цього є процес, розроблений Фріцем Габером, який, використовуючи принцип Ле Шательє, економічно створив шлях для виробництва аміаку з атмосферного азоту.
Далі ми розглянемо хімічну рівновагу згідно із законом Шательє та те, як збурення можуть її змінити.
знати більше про:
- Хімічний баланс
- Іонний баланс
- Кислотно-основні показники
Ефект концентрації
Коли існує хімічний баланс, система збалансована.
Система в рівновазі може зазнати порушень, коли:
- Збільшуємо концентрацію компонента реакції.
- Ми знижуємо концентрацію компонента реакції.
Коли ми додаємо або видаляємо речовину з хімічної реакції, система протистоїть змінам, споживаючи або виробляючи більше цієї сполуки, щоб баланс відновився.
Концентрації реагентів і продуктів змінюються для адаптації до нової рівноваги, але константа рівноваги залишається незмінною.
Приклад:
В підсумку:
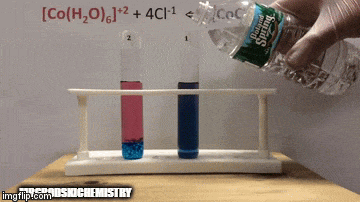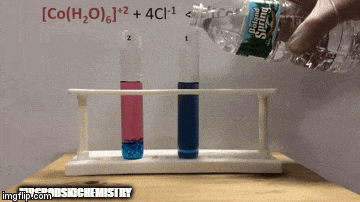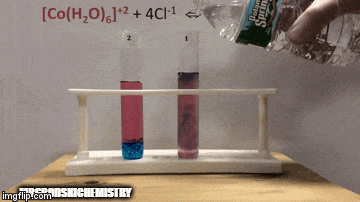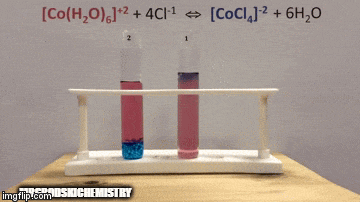
Реакція має більш високу концентрацію продуктів, оскільки за синім кольором розчину ми бачимо, що [комплекс CoCl4]-2 переважає.
Вода також є продуктом прямої реакції, і коли ми збільшуємо її концентрацію в розчині, система протистоїть змінам, викликаючи реакцію води та комплексу.
Рівновага зміщується вліво, у зворотному напрямку реакції, і змушує концентрацію реагентів збільшуватися, змінюючи колір розчину.
Вплив температури
Система в рівновазі може зазнати порушень, коли:
- Відбувається підвищення температури системи.
- Відбувається зниження температури системи.
Додаючи або вилучаючи енергію з хімічної системи, система протистоїть змінам, поглинаючи або вивільняючи енергію, щоб відновити баланс.
Коли система змінює температуру, хімічний баланс змінюється наступним чином:
Підвищуючи температуру, сприяє ендотермічній реакції, і система поглинає тепло.
З іншого боку, при зниженні температури екзотермічна реакція сприяє, і система виділяє тепло.
Приклад:
За хімічним балансом:
Коли ми поміщаємо пробірку, що містить цю систему, у склянку з гарячою водою, температура системи зростає, і рівновага зміщується, утворюючи більше продуктів.

Це пов’язано з тим, що пряма реакція є ендотермічною, і система буде відновлена шляхом поглинання тепла.
Крім того, коливання температури також змінюють константи рівноваги.
Ефект тиску
Система в рівновазі може зазнати порушень, коли:
- Відбувається збільшення загального тиску в системі.
- Відбувається зниження загального тиску в системі.
Коли ми збільшуємо або зменшуємо тиск хімічної системи, система протистоїть змінам, витісняючи баланс у значенні меншого або більшого обсягу відповідно, але не змінює константу рівноваги.
Коли система варіює об'єм, вона мінімізує дію прикладеного тиску наступним чином:
Чим більший тиск, що застосовується до системи, відбуватиметься скорочення об’єму і рівновага зміщується в бік меншої кількості родимок.
Однак, якщо тиск зменшується, система розширюється, збільшуючи об’єм і напрямок реакції зміщується в ту, що має найбільшу кількість родимок.
Приклад:
Клітини нашого організму отримують кисень через хімічний баланс:
Ця система встановлюється, коли кисень у повітрі, яким ми дихаємо, стикається з гемоглобіном, що знаходиться в крові, і в результаті виникає оксигемоглобін, який несе кисень.
Коли людина піднімається на гору, чим вище досягається висота, тим менша кількість і парціальний тиск О2 у повітрі.
Баланс, який несе кисень в організмі, зміщується вліво і зменшує кількість оксигемоглобіну, погіршуючи кількість кисню, що надходить у клітини.
Результатом цього є поява запаморочення та втоми, що може призвести навіть до смерті.
Організм намагається реагувати, виробляючи більше гемоглобіну. Однак це повільний процес, який вимагає встановлення на висоті.

Тому люди, які можуть піднятися на Еверест, є тими, хто найкраще підходить для екстремальної висоти.
Каталізатори
Використання каталізатора перешкоджає швидкості реакції як при прямій, так і при зворотній реакції.
Щоб відбулася реакція, необхідно досягти мінімальної енергії, щоб молекули стикалися і ефективно реагували.
Коли каталізатор вводиться в хімічну систему, діє, зменшуючи цю енергію активації, утворюючи активований комплекс і створюючи коротший шлях для досягнення хімічного балансу.
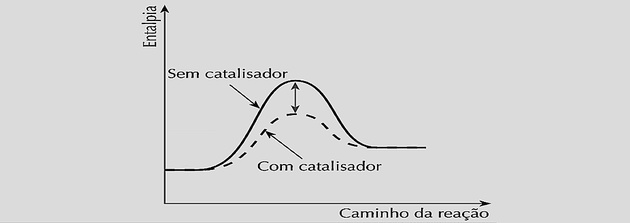
Збільшуючи швидкість реакції однаково, це зменшує час, необхідний для досягнення рівноваги, як це видно з наступних графіків:
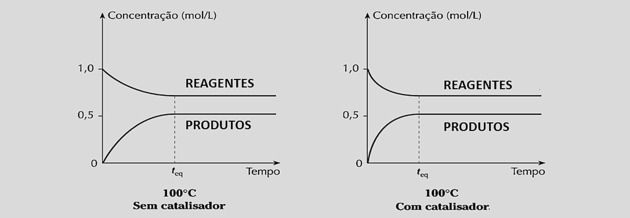
Однак використання каталізаторів не змінює вихід реакції або константу рівноваги, оскільки це не впливає на склад суміші.
синтез аміаку
З'єднання на основі азоту широко використовуються серед сільськогосподарських добрив, вибухових речовин, ліків, серед інших. Завдяки цьому отримують мільйони тонн сполук азоту, таких як аміак NH3, NH аміачна селітра4БІЛЯ3 та сечовина H2NCONH2.
Через світовий попит на сполуки азоту, головним чином для сільськогосподарської діяльності, селітра NaNO в Чилі3, основне джерело азотистих сполук, було найбільш уживаним до початку 20 століття, але природна селітра не могла забезпечити поточний попит.
Цікаво відзначити, що атмосферне повітря - це суміш газів, що складається з понад 70% азоту N2. Однак завдяки стабільності потрійного зв'язку це стає дуже складним процесом розриву цього зв’язку з утворенням нових сполук.
Рішення цієї проблеми запропонував німецький хімік Фріц Хабер. Синтез аміаку, запропонований Хабером, забезпечує наступний хімічний баланс:
Для промислового впровадження цей процес був вдосконалений Карлом Бошем і є найбільш використовуваним на сьогоднішній день для уловлювання азоту з повітря з акцентом на отриманні азотистих сполук.
Використовуючи принцип Ле Шательє, хімічний баланс можна збільшити, якщо:
Додайте H.2 і змушує систему протистояти змінам і реагувати на зниження концентрації цього реагенту.
Таким чином, H2 і ні2 їх споживають одночасно, щоб отримати більше продукту і створити новий стан рівноваги.
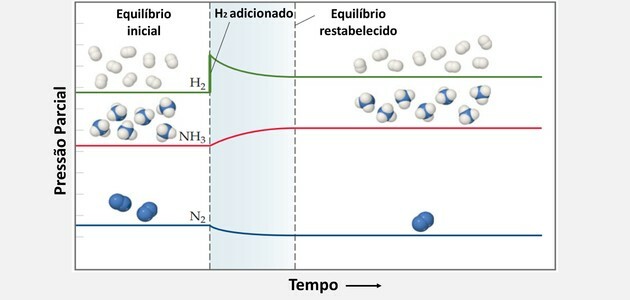
Так само, коли додається більше азоту, баланс зміщується вправо.
Промислово баланс зміщується безперервним видаленням NH3 системи шляхом селективного зрідження, збільшуючи вихід реакції, оскільки баланс, що підлягає відновленню, має тенденцію утворювати більше продукту.
Синтез Габера-Боша є одним з найважливіших застосувань досліджень хімічної рівноваги.
Завдяки актуальності цього синтезу, Хабер отримав Нобелівську премію з хімії в 1918 році, а Босх був нагороджений премією в 1931 році.
Вправи на зміну рівноваги
Тепер, коли ви знаєте, як інтерпретувати зміни, які можуть відбутися в хімічному балансі, використовуйте ці вестибулярні питання, щоб перевірити свої знання.
1. (UFPE) Найбільш придатними антацидами повинні бути ті, які не надто знижують кислотність у шлунку. Коли зниження кислотності занадто велике, шлунок виділяє надлишок кислоти. Цей ефект відомий як "кислотний реванш". Який із наведених нижче пунктів може бути пов’язаний з цим ефектом?
а) Закон енергозбереження.
б) Принцип виключення Паулі.
в) Принцип Ле Шательє.
г) Перший принцип термодинаміки.
д) Принцип невизначеності Гейзенберга.
Правильна альтернатива: в) принцип Ле Шательє.
Антациди - це слабкі основи, які діють, збільшуючи рН шлунка і, як наслідок, знижуючи кислотність.
Зниження кислотності відбувається шляхом нейтралізації соляної кислоти, що знаходиться в шлунку. Однак, занадто знижуючи кислотність, це може створити дисбаланс в організмі, оскільки шлунок працює в кислому середовищі.
Як зазначається в принципі Ле Шательє, коли рівноважна система піддається порушенню, буде протидіяти цій зміні, щоб рівновага була відновлена.
Таким чином, організм буде виробляти більше соляної кислоти, виробляючи ефект «кислотного реваншу».
Інші принципи, представлені в альтернативах, стосуються:
а) Закон енергозбереження: у серії перетворень зберігається загальна енергія системи.
б) Принцип виключення Паулі: в атомі два електрони не можуть мати однаковий набір квантових чисел.
г) Перший принцип термодинаміки: зміна внутрішньої енергії системи - це різниця між теплообміном та виконаною роботою.
д) Принцип невизначеності Гейзенберга: неможливо визначити швидкість і положення електрона в будь-який момент.
Щодо системи в рівновазі, можна правильно сказати, що:
а) наявність каталізатора впливає на склад суміші.
б) наявність каталізатора впливає на константу рівноваги.
в) збільшення тиску зменшує кількість СН4(g).
г) підвищення температури впливає на константу рівноваги.
д) підвищення температури зменшує кількість СО(g) .
Правильна альтернатива: г) підвищення температури впливає на константу рівноваги.
Підвищуючи температуру, буде впливати на пряму реакцію, яка є ендотермічною, оскільки для відновлення рівноваги система поглинатиме енергію та зміщуватиме рівновагу вправо.
Зміщуючи баланс у прямому напрямку, кількість утвореної продукції збільшується.
Константа рівноваги прямо пропорційна концентрації продуктів: чим більша кількість продуктів, тим більше значення константи.
Тоді ми можемо спостерігати, що підвищення температури збільшує кількість CO і H2.
Збільшення тиску зміщує рівновагу до зворотної реакції, оскільки рівновага зміщується в бік найменшої кількості молей. При цьому, кількість СН4 та H2Доповнений.
Використання каталізатора не заважає константі рівноваги та складу суміші. Це діятиме лише для того, щоб швидше досягти рівноваги.
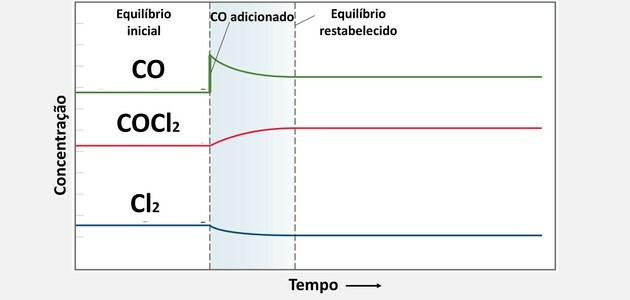
3. (UFC) При дослідженні дії отруйного газу COCl2, що використовується як хімічна зброя, процес розкладання спостерігається відповідно до реакції:
Починаючи із ситуації рівноваги, додавали 0,10 моль CO, і система через деякий час дійшла до нової ситуації рівноваги. Виберіть варіант, який вказує на те, як нові рівноважні концентрації пов’язані зі старими.
| [COCl2] | [CO] | [Кл2] | |
| The) | новий> старий | новий> старий | новий |
| Б) | новий> старий | новий> старий | новий> старий |
| ç) | новий | новий> старий | новий |
| г) | новий> старий | новий | новий |
| і) | те саме | те саме | те саме |
Правильна альтернатива:
| [COCl2] | [CO] | [Кл2] | |
| The) |
Коли додається нова речовина, система споживає цю речовину для відновлення балансу, оскільки її концентрація зросла.
Це споживання відбувається завдяки тому, що речовина реагує з іншою сполукою, створюючи тим самим більше продукту.
Отже, коли ми збільшуємо концентрацію СО, буде споживання, але не до того, щоб стати нижче концентрації у вихідному стані, оскільки її споживання відбуватиметься разом з іншим компонент.
Вже концентрація Cl2 стає меншим за початковий, оскільки він повинен був реагувати з кількістю доданого СО.
З місця з'єднання двох речовин концентрація COCl була збільшена2, оскільки це утворений продукт.
Ці зміни хімічного балансу можна побачити на графіку нижче:
4. (UFV) Експериментальне дослідження хімічної реакції в рівновазі показало, що збільшення Температура сприяла утворенню продуктів, тоді як підвищення тиску сприяло утворенню реагенти. Виходячи з цієї інформації та знаючи, що A, B, C та D є газами, позначте альтернативу, яка представляє вивчене рівняння:
| The) | ||
| Б) | ||
| ç) | ||
| г) | ||
| і) |
Правильна альтернатива:
| The) |
Зі збільшенням температури система поглинає тепло для відновлення рівноваги і, тим самим, сприяє ендотермічній реакції, ∆H якої є позитивною.
Альтернативами, які відповідають сприянню утворенню продуктів за рахунок підвищення температури, є: a, b і d.
Однак, коли тиск зростає, рівновага зміщується в бік найменшого об’єму, тобто такого, що має найменшу кількість родимок.
Щоб реакція рухалась у бік реагентів, необхідно, щоб цей напрям реакції мав меншу кількість молей по відношенню до продуктів.
Це спостерігається лише в першій альтернативі.
5. (UEMG) Наступні рівняння представляють системи в рівновазі. Яка єдина система, яка не зміщується при зміні тиску?
а) ОС2 (г) + 1/2 O2 (г) ТАК3(g)
б) CO2 (г) + H2 (г) ⇔ CO(g) + H2О(g)
в) Ні2 (г) + 3 год2 (г) ⇔ 2 NH3(g)
г) 2 CO2 (г) CO 2 CO(g) + O2 (г)
Правильна альтернатива: b) CO2 (г) + H2 (г) ⇔ CO(g) + H2О(g)
Коли система змінює загальний тиск, баланс відновлюється зі зміною обсягу.
Якщо тиск зростає, об’єм зменшується, зміщуючи рівновагу до найменшої кількості родимок.
З іншого боку, коли тиск зменшується, об’єм збільшується, зміщуючи баланс у бік більшої кількості родимок.
Але коли утворюється однакова кількість молей реагуючих речовин і продуктів, зрушити рівновагу неможливо, оскільки об’єм не змінюється.
Кількість родимок ми знаємо за стехіометричними коефіцієнтами біля кожної речовини.
Це ми можемо побачити в альтернативному рівнянні
б) CO2 (г) + H2 (г) ⇔ CO(g) + H2О(g)
де 1 моль CO2 реагує з 1 молями Н2 з утворенням 1 моль CO і 1 моль H2О.
В обох напрямках реакції є 2 моля, тому зміни тиску не змінять об’єм.
Перегляньте більше запитань щодо витіснення рівноваги хімічної речовини з коментованою роздільною здатністю у цьому списку, який ми підготували: вправи на хімічний баланс.
Ким був Ле Шательє?