Об'ємний аналіз або об'ємність це лабораторна процедура, в якій ми використовуємо певний об'єм рішення в концентрація відомо, що для визначення концентрації іншого розчину. Об'єм розчину відомої концентрації буде визначений, коли він повністю вступить у реакцію з розчином невідомої концентрації, тобто залучені розчини повинні реагувати між собою.
Для вимірювання даного об'єму найбільш використовуються прилади:
- Піпетка

Приклад піпетки, що використовується для вимірювання об'єму
- Бюретка

Бюретка є важливим об'ємним вимірювальним обладнанням
Вимірювання об’єму проводиться шляхом оцінки висоти так званого меніска, що є не що інше, як область поверхні рідини, яка має прямокутний або куполоподібний вигляд (форма краплі), залежно від товщини контейнера. Чим ширший контейнер, тим більш прямокутний меніск; чим тонша ємність, тим вона буде опуклішою. Для оцінки меніска око повинно бути точно на висоті, і ми повинні використовувати нижню область як еталон, якщо меніск прямокутний, або кінчик, якщо опуклий. Див. Подання оцінки:
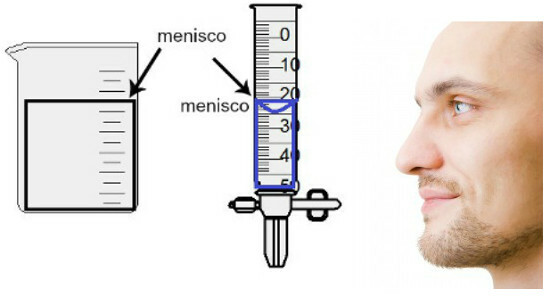
Щоб оцінити меніск, важливо, щоб ваші очі дивилися на нього.
При об'ємному аналізі найбільш використовуваним обладнанням є бюретка. Це пояснюється тим, що, оскільки метод передбачає хімічні реакції, і їх можна швидко обробити, бюретка дозволяє рідина виділяється на кінчику краплями, що дозволяє нам зупинити рідину більше виходити контрольований.
Однією з найбільш часто використовуваних процедур об'ємної обробки є титрування. Це об'ємний аналіз, який включає виникнення реакції між кислотою та основою або навпаки. Обладнання, необхідне для його реалізації, представлене на зображенні нижче:
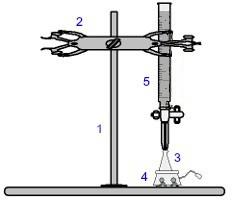
Відображення обладнання, що використовується при титруванні
Цифри синього кольору означають:
1) Універсальна підтримка;
2) Кіготь (використовується для утримання бюретки);
3) Ерленмейєр (отримує розчин невідомої концентрації);
4) Магнітна мішалка (використовується для перемішування розчину, присутнього в колбі Ерленмейера);
5) Бюретка (отримує розчин відомої концентрації).
Об'єм розчину невідомої концентрації з показником фенолфталеїну додають до колби Ерленмейєра (негайно розчин набуває рожевого кольору). У бюретку поміщають певний об’єм розчину відомої концентрації. Потім розчин кислоти з бюретки безпосередньо капає в основний розчин у колбі Ерленмейера. Ця крапля триває до тих пір, поки розчин основи не стане безбарвним, і в цей момент ми називаємо точку повороту, яка вказує на те, що вся основа, що знаходиться в розчині, повністю прореагувала з кислотою.
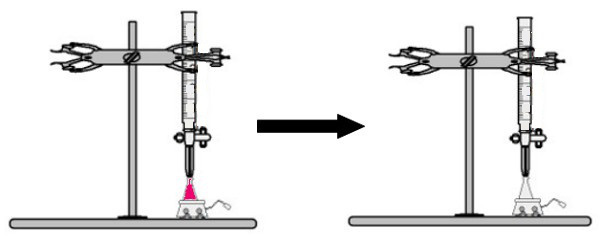
У поворотний момент розчин перестає бути рожевим і стає безбарвним
Спостереження: Якщо розчин невідомої концентрації є кислотою, коли він отримує індикатор фенолфталеїну, він буде безбарвним. Таким чином, поворотним пунктом у титруванні буде той момент, коли кислий розчин стає рожевим при отриманні основного розчину з бюретки.
Нарешті, щоб визначити концентрацію основного розчину, просто скористайтеся наступним рівнянням:
Ma.Va = Mb.Vb
Ma = кислотна молярність;
Va = об'єм кислоти;
Mb = базова молярність;
Vb = базовий об'єм.
Тепер перейдіть за прикладом того, як проводиться розрахунок розчину з невідомою молярністю.
1-й) 30 мл невідомого розчину основи додавали до колби Ерленмейєра для проведення титрування для визначення його концентрації (молярності). У бюретку додавали 50 мл розчину кислоти з концентрацією 0,2 моль / л. Після скидання розчину кислоти і до титрування основного розчину спостерігали, що для титрування використовували 20 мл розчину кислоти. Визначте молярність використовуваного розчину основи.
Дані вправи:
Vb = 30 мл
Мб =?
Ма = 0,2 моль / л
Va = 20 мл
Оскільки молярність кислоти та її об’єм становлять, відповідно, 0,2 моль / л та 20 мл, а об’єм використовуваної основи становить 30 мл, просто використовуйте формулу титрування:
Ma.Va = Mb.Vb
0,2.20 = Mb.30
4 = Mb.30
4 = Мб
30
Mb = 0,133 моль / л
Мені Діого Лопес Діас
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm
