визначає себе як гібридизація об'єднання неповних атомних орбіталей. Орбіталь класифікується як неповна, коли вона має лише одну електрон всередині нього замість двох. Дивіться подання неповної орбіталі та повної орбітали:

На зображенні А ми маємо повну орбіталь; на зображенні В неповна орбіталя.
Гібридизація - природне явище, яке відбувається з деякими хімічними елементами, такими як фосфор, сірка, вуглець тощо. Гібридизація вуглецю дозволяє атомам цього елемента бути здатними до утворення чотирьох хімічних зв’язків, тобто вуглець утворює чотири зв’язки лише після феномену гібридизації.
Але чому вуглець гібридизується і утворює чотири зв’язки? Щоб зрозуміти це явище, ми повинні знати електронний розподіл цього елемента:
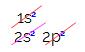
При електронному розподілі вуглецю ми бачимо, що 1-й підрівень є повним (з двома електронами), 2s є повним (з двома електронами), а 2p підрівнем є неповним (p підрівнем підтримується шість електронів, але існує лише два). Розподіляючи 2p-електрони репрезентативно, ми повинні:
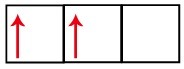
Рівень р має три орбіталі - у випадку вуглецю дві з них неповні, а одна порожня. З цієї причини цей елемент повинен виконувати лише два посилання, оскільки кількість неповних орбіталей завжди визначає кількість посилань.
Однак, отримуючи енергію із зовнішнього середовища, електрони, присутні у вуглеці, збуджуються. Таким чином, один з електронів, присутніх у підрівні 2s, рухається до порожньої орбіталі підрівню p:
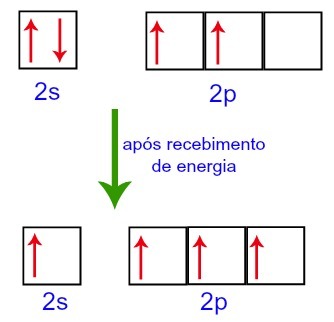
Карбонові орбітали до і після отримання енергії із зовнішнього середовища
Таким чином, на другому рівні вуглецю залишаються чотири неповні орбіталі. Потім орбіталя 2-го підрівня приєднується до трьох р-орбіталей, що налаштовує явище гібридизація.
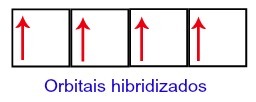
Вуглецеві орбіталі після гібридизації
Мені Діого Лопес Діас
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm
