Органічні сполуки молекулярні, тобто їх атоми несуть між собою ковалентні зв’язки. Коли ми аналізуємо зв’язки між вуглецями, які можуть бути одинарними, подвійними або потрійними, ми спостерігаємо, що вони є неполярні зв’язки, оскільки різниці в електронегативності між атомами немає, оскільки вони належать до тих самих елемент.
Крім того, оскільки водень і вуглець мають дуже малу різницю в електронегативі, зв’язки між ними також неполярні.
Неполярні з'єднання:
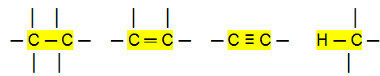
З цього можна зробити висновок, що Вуглеводні (органічні сполуки, що мають лише атоми вуглецю та водню) є неполярними молекулами. У цих сполуках міжмолекулярна взаємодія має індукований дипольний тип, який є найслабшим із існуючих.
Оскільки вони слабкі, ці взаємодії легко порушити. Через це, температури кипіння та плавлення вуглеводнів нижчі, ніж у інших функцій.

Порівнюючи вуглеводні, точки кипіння збільшуватимуться із збільшенням молярної маси.
Наприклад, етан і бутан є алканами. Подивіться точки кипіння кожного експериментально визначеного:
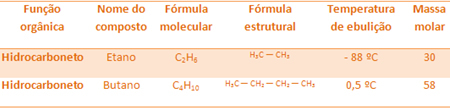
Зверніть увагу, що температура кипіння бутану набагато вища, ніж температури етану, оскільки його молярна маса також вища.
Тепер, коли ми порівнюємо вуглеводні, які мають однакову молярну масу (вони є ізомерами), але які мають різні типи вуглецевих ланцюгів, ми усвідомлюємо, що чим більша кількість гілок, тим нижча температура кипіння, оскільки структура молекули стає більш компактною, тобто її поверхня зменшується.
Всі алкани нижче мають однакову молекулярну формулу С5H12, але їх температури кипіння різні:
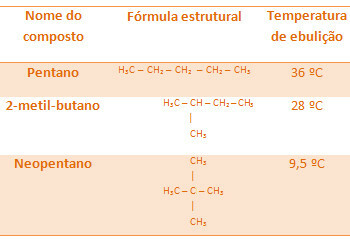
Зверніть увагу, що температура кипіння неопентану найнижча, оскільки у нього більше гілок.
Ми можемо вважати, що інші органічні функції походять від вуглеводнів шляхом заміщення одного або декількох воднів атомами або групами атомів інших елементів. Як правило, інші органічні функції мають кисень або азот, які є більш електронегативними елементами, ніж вуглець. Вони сильніше притягують пару електронів, спільних з вуглецем, і, отже, роблять молекулу полярною:
Полярні з'єднання:
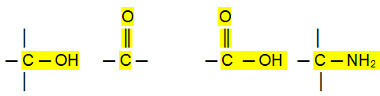
Альдегіди, кетони та органічні галогеніди мають вищі температури кипіння, ніж вуглеводнів, оскільки їх міжмолекулярна взаємодія є постійним диполем, який є сильнішим, ніж індукований дипол.
З іншого боку, спирти, карбонові кислоти та аміни мають ще більш високі температури кипіння, оскільки вони здійснюють водневі зв’язки - найбільш інтенсивний тип міжмолекулярної взаємодії.
У сполуках усіх цих функцій застосовується те саме, що ми бачили для вуглеводнів:

Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm
