THE константа іонізації дає Вода(КВт), О водневий потенціал(рН) це гідроксильний потенціал (pOH) вони є заходів важливо для розрахунків, що включають хімічний баланс у кислих та основних розчинах, а також при визначенні концентрації іонів Н+ і о- відповідних рішень.
Що таке Kw?
Іонний продукт води, або Kw (це wзасоби води - вода, англійською мовою) - це константа, яка використовується для представлення баланс, що утворюється в результаті самоіонізації води. Навіть при дуже малій швидкості вода іонізується, утворюючи іони Н+ і о-, згідно з наступним хімічним рівнянням:
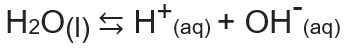
Аналізуючи рівняння, ми усвідомлюємо, що коли іонізація з молекули чистої води утворюється іон Н.+ і іон ОН-, тобто концентрація цих іонів завжди буде однаковою. Навіть коли відбувається підвищення температури, що спричиняє збільшення швидкості іонізації, концентрації залишаються незмінними.
Читайте також:Енергія іонізації
Не зупиняйтесь зараз... Після реклами є ще щось;)
На основі експериментальних вимірювань була розрахована концентрація іонів Н
+ і о- (в результаті самоіонізації води) при 25 ° C і значенні 1. 10-7 моль / л. Це, з 1 мільярда молекул води, лише два проходять іонізацію. Це показує, що чиста вода має низький ступінь іонізації, і пояснює дуже низький Електропровідність чистої води.Беручи до уваги те, що було показано вище, ми можемо написати вираз константи водного балансу:

Використання значень концентрації іонів Н+ і о- при 25 ° C, ми можемо розрахувати значення Kw:
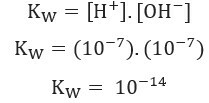
Як зазначалося раніше, це значення Кw змінюється зі збільшенням температури, як показано в таблиці нижче:
T (° С) |
Кw |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
Щоб дізнатись більше про цю тему, прочитайте наш текст: Іонний водний продукт.
Що таке pH і pOH?

скорочення рН засоби водневий потенціал і була створена данським біохіміком Сорен Соренсен, в 1909 р., для полегшення роботи з концентрації іонів водню [H+], які зазвичай виражаються десятковими числами. Щоб дізнатись більше про цю тему, прочитайте наш текст: Що таке рН?
Цей вид позначень позначає вміст іонів Н+ присутній у розчині і визначається математичним виразом:
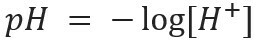
Подібним чином ми можемо визначити pOH або гідроксильний потенціал, який говорить нам про Вміст іонів ОН- присутній у розчині. Його математичний вираз:
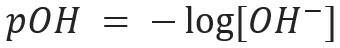
У водному розчині завжди будуть іони Н+ і о- (внаслідок іонізації, яку зазнає вода), яка буде використана для характеристики розчину в кислий або основний. Чим більше іонів Н+ є в розчині, тим кислотнішим він буде. Отже, наявність іонів ОН- у рішенні зробить його більш базовим. Якщо існує рівновага в кількості цих іонів, розчин буде класифікований як нейтральний.
шкала рН
Шкала рН відображається зі значеннями від 0 до 14 (значення, виміряні при 25 ° C). Дивіться шкалу рН на зображенні нижче:

Чим нижчий рНрозчину,більша його кислотність, і чим ближче до кінця шкали, тобто ближче до 14, тим більшим буде її основний характер. Наприклад, лимонний сік має рН 2, тоді як відбілювачі мають рН 12.
Як розрахувати pH та pOH
знаючи концентрація іонів, ми можемо обчислити значення pH і pOH розчинів, і, знаючи потенційні значення, ми обчислюємо концентрація іонів у розчинах. Для цього використовуються такі вирази:
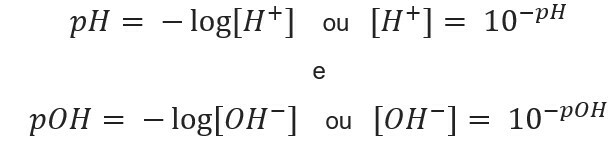
Перейдемо до прикладів:
Приклад 1
Якщо ми хочемо знати рН розчину з [H+] = 0,001 моль / л, просто використовуйте представлену раніше формулу:
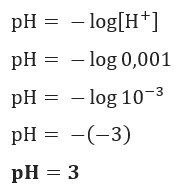
Приклад 2
Тепер, щоб з’ясувати, яка концентрація ОН- розчину з pOH = 5, просто замініть значення в наступній формулі:

Якщо застосувати ту саму шкалу потенціалів для іонного балансу води, ми матимемо:
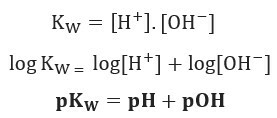
Як зазначалося, при 25 ° C, Kw = 10-14. Тому:

Завдяки цьому ми можемо розрахувати рН розчину на основі його рН. Якщо ми маємо розчин з рН 3, то його рОН буде 11.
Дізнайтеся більше: Нейтральні, кислі та основні середовища
Вправи вирішені
Питання 1 (UEFS-BA) Концентрація іонів ОН–(тут) в даному розчині гідроксиду амонію при 25 ° С дорівнює 1,10–3 моль / л. РОН цього розчину:
а) 0
б) 1
в) 3
г) 11
д) 13
Дозвіл: Літера С. Якщо ми маємо [ОН–] = 10–3 моль / л, тож ваш pOH буде дорівнює 3.
Подивіться:
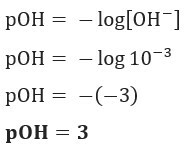
Питання 2 (UEA-AM) Розглянемо наступну інформацію, отриману на маркуванні мінеральної води у місті Порто-Сегуро (Балабан):
нітрат 1,45 мг / л
рН при 25 ° C 4,51
Ця мінеральна вода є
а) кислий і має [H+] –].
б) кислий і має [H+]> [ОН–].
в) нейтральний і має [H+] = [ОН–].
г) основний і має [H+]> [ОН–].
д) основний і має [H+] –].
Дозвіл: Літера Б. Оскільки рН мінеральної води, вказаної на етикетці, менше 7, можна сказати, що це кислий розчин і, отже, концентрація іонів Н+ більше, ніж OH-.
Запитання 3 (UEA-AM) Одним із способів швидкого отримання газоподібного водню в лабораторії є взаємодія порошкоподібного металевого цинку з соляною кислотою (HCl) при концентрації 1,0 моль / л:
Zn (s) + 2 HCl (aq) → ZnCl2 (aq) + H2 (g)
Враховуючи, що соляна кислота на 100% іонізована і що розчин знаходиться при 25 ° С, правильно стверджувати, що рН розчину соляної кислоти, згаданого в тексті, становить
- 0
- 1
- 3
- 13
- 14
Дозвіл:Літера а. Ми можемо розрахувати рН розчину, використовуючи концентрацію HCl, зазначену в тексті, оскільки, оскільки він 100% іонізований, концентрація [H+] буде однаковим, оскільки на кожну іонізовану молекулу HCl припадає один іон Н+ буде сформовано. Тому:
Віктор Феррейра
Вчитель хімії