“Хімічний зв’язок »- термін, вперше використаний Гілбертом Ньютоном Льюїсом у 1920 році в статті, щоб пояснити, чому що атоми злипаються, утворюючи речовини, а також чому вони злипаються над тисячами років.
Атоми більшості хімічних елементів, відомих дотепер і перелічених у Періодичній системі, у природі не зустрічаються в ізольованому вигляді. Більшість матеріалів, що присутні в нашому повсякденному житті, - це речовини, які можуть бути простими (складаються з атомів лише одного типу хімічного елемента) або композити (мають атоми двох або більше хімічних елементів багато різних).
Це пов’язано з тим, що атоми мають здатність зв’язувати хімічні зв’язки з іншими атомами, які можуть бути тим самим елементом або різними елементами. Ці зв’язки настільки міцні, що без будь-якого зовнішнього впливу в більшості випадків атоми залишаться з’єднаними, як вони є.
Карта розуму: Хімічні зв’язки

* Щоб завантажити карту розуму в PDF, Натисніть тут!
Наприклад, нам не властиво знаходити вільний атом кисню в природі; однак ми знаходимо кілька речовин, у яких він виявляється приєднаним до інших атомів. Прикладом простої речовини є газ кисень, у якому кожна молекула утворена двома зв’язаними атомами кисню (O
2); тоді як прикладом складеної речовини є вода, де кожна молекула має два атоми водню, зв’язані з атомом кисню (Н2О).Єдиними елементами, які стабільно ізольовані в природі, є благородні гази, тобто елементи сімейства 18 Періодичної системи (He, Ne, Ar, Kr, Xe та Rn). Для всіх цих елементів спільним є те, що вони мають вісім електронів в останній електронній оболонці (валентний шар), за винятком гелію (He), який має лише одну електронну оболонку (шар K) і, отже, утримує два електрони, що є максимально можливою кількістю електронів у цьому шар.
Таким чином, Гілберт Н. Льюїс, а також вчений Вотер Коссель дійшли висновку, що атоми інших елементів зв’язуються з вісьмома електронами (або двома, якщо у вас є лише оболонка K) і таким чином стабілізуються. Тоді він був створений електронна теорія валентності, що вказує на те, скільки хімічних зв’язків утворює атом елемента, виходячи з пояснюваної ідеї.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Отже, атоми створюють хімічні зв’язки, прагнучи втратити, отримати або поділити валентні електрони оболонки, поки вони не досягнуть конфігурації наступного благородного газу.Ця теорія також стала називатися правило октету.
Наприклад, кисень є двовалентним, оскільки у валентній оболонці має шість електронів. Отже, йому потрібно отримати ще два електрони, щоб мати конфігурацію благородного газового неона (Ne), тобто з вісьмома електронами у валентній оболонці, яка в даному випадку є L-оболонкою. У випадку згаданих газів кисню та води ми маємо наступне:
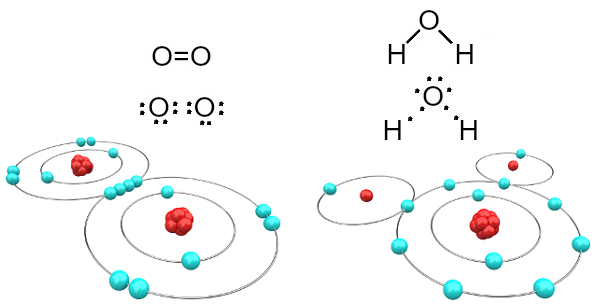
Молекули кисню та води, утворені ковалентними зв’язками
Зауважимо, що в першому випадку (кисневий газ - O2), кожен атом кисню має два електрони, обидва з яких мають по вісім електронів у валентній оболонці. Це означає, що a подвійний зв’язок (два зв’язки одночасно між двома атомами).
У випадку з водою кожен з двох атомів водню поділяє електрон з центральним атомом кисню і всі стабільні (кисень має вісім електронів у валентній оболонці, а кожен водень - два електрони). Тут також встановлено два простих з'єднання.
Цей тип хімічного зв’язку, при якому всі атоми повинні отримувати електрони (водень, неметали та напівметалли) і в якому електрони діляться парами, називається ковалентний зв’язок.
Але є ще два типи хімічних зв’язків:
(1) іонний зв’язок → відбувається остаточний перенос електронів від одного атома до іншого. Цей тип зв’язку відбувається між атомами металу (які мають тенденцію втрачати електрони, щоб затриматися стабільні) та атоми водню, неметали та напівметали (які мають тенденцію набирати електрони, щоб затриматися стабільний).
Прикладом може бути хлорид натрію (NaCl - кухонна сіль), де натрій - це метал, який має тенденцію втрачати електрон, тоді як хлор - це неметал, який має тенденцію отримувати електрон. Таким чином, натрій дарує(червона стрілка)електрон до хлору, утворюючи сіль, дуже стабільну речовину. Оскільки вони закінчують (чорна стрілка) іони, які є хімічними видами з протилежними зарядами (+ і -), один іон привертає інший поблизу, і іонні скупчення утворюються з величезною кількістю іонів, як і кристали кухонної солі.

Утворення хлориду натрію шляхом іонного зв’язку
(2) Металеве з'єднання → Це теорія, згідно з якою метали (такі як алюміній, золото, срібло, мідь тощо) утворені скупченням атомів нейтронів і катіони, які утримуються разом своєрідною "хмарою" вільних електронів (електронів, які були втрачені при утворенні катіонів цитується). Ця хмара (або море) електронів діятиме як металевий зв’язок, який утримуватиме атоми.
Детальніше про ці типи хімічних зв’язків, а також про правило октету читайте у відповідних статтях нижче.
Карта розуму М.е Віктор Рікардо Феррейра
Вчитель хімії
Дженніфер Фогача
Закінчив хімію
Хімія

Іонний зв’язок, домовленості між іонними сполуками, іонними агломератами, хлоридом натрію, кухонною сіллю, іонною речовиною, електростатичні сили притягання, хлоридні аніони, катіони натрію, полярні розчинники, позитивні іони, катіони, негативні іони, аніони.


