Закон Гесса був створений швейцарським хіміком Жерменом Х. Гесс (1802-1850), який вважається одним із засновників термохімії. Його закон сказав:

Тобто ΔH залежить лише від значень ентальпії реагентів та продуктів, як у виразі:
| ΔH = ΔHреагенти + ΔHпродуктів |
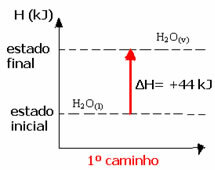
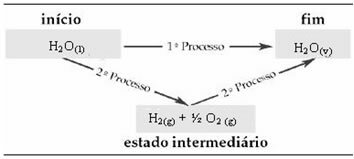
Наприклад, розглянемо реакцію, коли 1 моль води (H2О) перетворюється у воду в газоподібному стані. Ця реакція проводиться двічі; проте були обрані різні шляхи:
(1-й) Це було здійснено в один крок:
H2О(1) → H2О(v) ΔH = +44 кДж
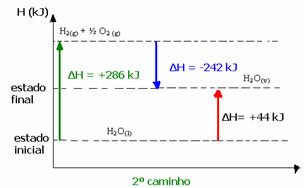
(2-й) Він проводився у два етапи:
1-й крок: H2О(1) → H2 (г) + ½2 (г) ΔH = +286 кДж
2 етап: Н2 (г) + ½2 (г) → H2О(v) ΔH = -242 кДж
H2О(1) → H2О(v) ΔH = +44 кДж
Не зупиняйтесь зараз... Після реклами є ще щось;)
Зауважте, що незалежно від того, чи було виконано один або два кроки, зміна ентальпії (ΔH) завжди становить 44 кДж. Це пояснюється тим, що ΔH - алгебраїчна сума значень valoresH етапів, що складають процес, тобто проміжних процесів:
| ΔH = ΔH1 + ΔH2 + ΔH3 + ... |
Наприклад, у другому випадку загальна ΔH реакції була сумою ΔH першої стадії (ΔH = +286 кДж) з такою на другій (ΔH = -242 кДж). Таким чином, ми отримали однакове значення реакції з одним кроком:
ΔH = (+286 + (-242)) кДж
ΔH = (+286 -242) кДж
ΔH = +44 кДж
Тому нас цікавлять лише початкові та кінцеві значення. У цьому випадку початковий стан відповідає H2О(1) і кінець до Н2О(v).
Цей закон набув великого значення в термохімії, оскільки певні хімічні реакції не можуть визначати ΔH експериментально. Однак, згідно із законом Гесса, ентальпію цього типу реакцій можна розрахувати з ентальпій інших реакцій (проміжних реакцій).
Дженніфер Фогача
Закінчив хімію
Шкільна команда Бразилії
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Закон Гесса»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/lei-hess.htm. Доступ 28 червня 2021 року.