Як показано в текстах "Електромагнітний спектр хімічних елементів"і"Спектри викидів та поглинання та закони Кірхгофа”, Спектри розривного випромінювання кожного хімічного елемента різні.

Отже, нижче ми маємо чіткі спектри деяких з цих елементів:

Так, датський фізик Нільс Бор (1885-1962) зрозумів, що це може бути пов'язано зі структурою атома кожного з цих елементів. Тож він запропонував атомну модель, яка доповнює модель Резерфорда, але зосереджена на поведінці навколишніх електронів в ядрі атома.
Деяким часом раніше Макс Планк (1858-1947) запропонував теорію, що це електрони квантовані, в тому сенсі, що вони випромінюють і поглинають певну кількість енергії, ніби це маленькі пакети енергії, який він назвав скільки (квантовий, в однині).
Таким чином, Бор запропонував наступне: оскільки кожен елемент має різний спектр, кожен елемент має в своєму атомі електрони постійної та різної енергії від елемента до елемента.
Кожен електрон може перебувати лише на певній конкретній орбіті, оскільки на кожній з цих орбіт електрон має постійну, чітко визначену і характерну енергію. Електрон може займати лише ті енергетичні рівні, для яких він має відповідну енергію.
Спектри розривні, тому що електрони квантовані.
Електрон може змінювати рівень, лише якщо він поглинає енергію. Наприклад, коли ви спалюєте натрієву сіль у пальнику Бунзена, ви подаєте енергію електронам. Поглинаючи квант енергії, електрон переходить на інший більш енергетичний рівень, залишаючись у збудженому стані. Однак основний стан є стабільнішим, тому цей електрон випромінює поглинену енергію і повертається на початкову орбіту. Він випромінює цю енергію у вигляді електромагнітних хвиль, які можна візуалізувати у вигляді світла. У випадку з натрієм це світло інтенсивно жовтого кольору. Таким чином, коли ці хвилі проходять крізь призму, отримується розривний спектр натрію.
Отже, для Бер, кожна світлова лінія, що з'явилася в розривному спектрі елементів, вказувала на енергію, що виділяється при поверненні електрона з одного зовнішнього рівня на ближчий до ядра.
Малюнок нижче допомагає краще зрозуміти цю проблему:
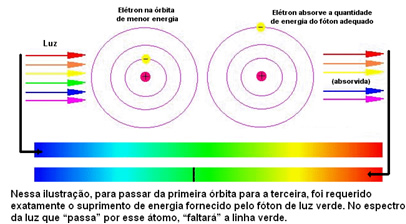
Оскільки для атомів кожного елемента дозволено лише певні значення енергії, які відповідають енергетичним шарам, для кожного елемента існує різний спектр.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm
