У лабораторіях та хімічній промисловості дуже важливо знати кількість речовин, що беруть участь у реакціях. Тому нижче ми розглянемо основні поняття, величини та одиниці виміру, пов’язані з масами атомів:
- Одиниця атомної маси (u):
Стандартним контрольним атомом ваги для позначення одиниці атомної маси є вуглець-12 (12Ç). Одиниця атомної маси (1 u) відповідає значенню 1,66054. 10-24 g, що є масою 1/12 ізотопу вуглецю масою, рівною 12 (12Ç).
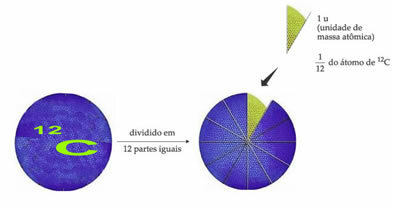
Одиниця атомної маси (u) - це одиниця виміру, що використовується у всіх перелічених нижче кількостях.
- Атомна маса атома або ізотопу (MA):
Його отримують шляхом порівняння з еталонним значенням, згаданим у попередньому пункті. Наприклад, атомна маса 919F задано мас-спектрометром, який дорівнює 18,9984 u. Округлюючи, воно дорівнює 19, що є таким самим значенням, як його масове число (А). Це значення означає, що атомна маса елемента 919F в 19 разів перевищує масу 1/12 12Ç.
- Атомна маса елемента (AM):
Атомна маса елемента визначається середньозваженою масою атомних мас його ізотопів. Це робиться шляхом множення атомних мас кожного ізотопу на відсоток, який з’являється в конституції елемента. Потім ці значення складаються, які діляться на 100, в результаті отримуючи загальний відсоток.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Наприклад, елемент неон складається з трьох ізотопів із наступними атомними масами та відсотками у їхній структурі:

Розрахунок атомної маси (МА) цього елемента:
БАДнеонові = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
БАДнеонові = 20,179 у
- Молекулярна маса (ММ):
Як випливає з назви, він використовується для молекулярних речовин, тобто атомів, зв'язаних через спільне використання пар електронів, які називаються ковалентними зв'язками.
Молекулярна маса отримується шляхом множення числа атомів кожного елемента на їх атомні маси та підсумовування результатів.
Наприклад, молекула CO2 містить один вуглець і два кисню, тому ми помножимо атомну масу вуглецю на 1; і кисень на два, додаючи їх пізніше:
ММCO2 = (1. БАДÇ) + (2. БАДО)
ММCO2 = (1. 12) + (2. 16)
ММCO2 = 12 + 32
ММCO2 = 44 u
- Масова формула:
Цей же розрахунок проводиться для молекулярної маси, проте для іонних сполук. У цьому випадку назва інша, оскільки вони групуються не в молекули, а в скупчення іонів. Оскільки молекул не існує, очевидно, немає сенсу говорити про молекулярну масу, але аргументи, що лежать в основі розрахунку, однакові.
Приклад:
NaCl
↓ ↓
23 +35,5 → Маса формули = 58,5 од
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Маси атомів»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm. Доступ 28 червня 2021 року.