Атоми - це нескінченно маленькі частинки, з яких складається вся речовина у Всесвіті. З часом уявлення про те, якою була б атомна структура, змінювалося згідно з новими відкриттями, зробленими вченими. Детальніше про це ви можете дізнатись у текстіЕволюція атомної моделі.
Модель - це репрезентація реальності (а не сама реальність), тому атомні моделі - це репрезентації основні компоненти атома та його будова та пояснюють певні фізичні та хімічні поведінки речовини. Це робиться тому, що людині ще не вдається побачити ізольований атом навіть за допомогою ультрамікроскопів.
Щоб отримати уявлення про те, наскільки малий атом, знайте це Найменша частинка, видима під звичайним мікроскопом, містить понад десять мільярдів атомів! Атом настільки малий, що, якби ми поставили мільйон з них поруч, ми б не дійшли до товщина волосся.
Карта розуму: Атом
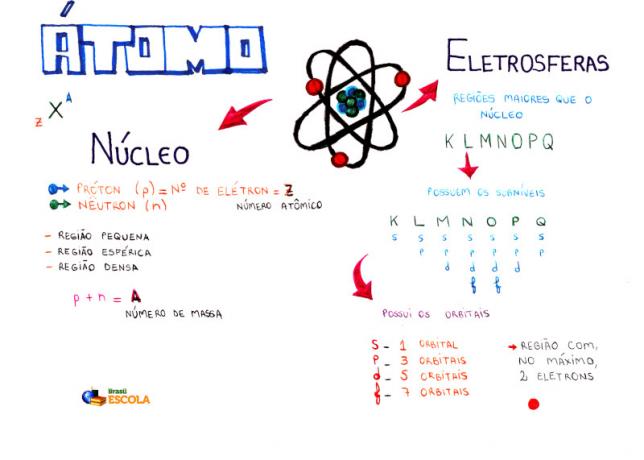
* Щоб завантажити карту розуму в PDF, Натисніть тут!
Серед атомних моделей найпоширенішою в даний час у середній школі для розуміння будови атома та його властивостей є модель Резерфорда-Бора. Відповідно до цієї моделі структура атома складається з двох основних частин:
ядро та електросфера.
Дві основні частини будови атома - електросфера та ядро
* Ядро: Складаючи центральну частину атома, він компактний, масивний і дуже щільний, крім того, утворюється частинками більшої маси, якими є протони та нейтрони.

Ілюстрація протонів та нейтронів, що складають атомне ядро
- Протони: це частинки з позитивним електричним зарядом (відносний заряд = +1; заряд в кулонах (С) = +1,602. 10-19), а його відносна маса дорівнює 1.
Той факт, що протони утворюють ядро і дають йому загальний позитивний заряд, був виявлений Євген Гольдштейн, в 1886 р. шляхом модифікації ампули Крукса та деяких експериментів. Він побачив, що при дуже високих напругах з'являються випромінювання (анодні промені - залишки атомів газу, що знаходилися всередині колби і в яких електрони розірвалися в результаті електричного розряду). Розмістивши електричне або магнітне поле поза колбою, ці промені відхилялися до негативного полюса. Це означало, що є позитивні субатомні частинки, які називали протонами.
Пізніше, Ернест Резерфорд (1871-1937) здійснив експеримент, описаний у тексті Атом Резерфорда, що призвело його до виявлення місця розташування протона: в ядрі.
- Нейтрони: це частинки з масою, рівною масі протонів (1), але, як випливає з назви, вони нейтральні, тобто не мають електричного заряду.
Нейтрони були відкриті в 1932 р Джеймс Чедвік (1891-1974), який зрозумів, що ядро радіоактивного берилію випускає нейтральні частинки з масою, приблизно рівною масі протонів (насправді вона трохи більша).
Не зупиняйтесь зараз... Після реклами є ще щось;)
Діаметр ядра залежить від кількості протонів і нейтронів, якими володіє атом, але в середньому він становить близько 10-14 місяць 10-15 м.
Атомне ядро концентрує практично всю масу атома, складаючи дуже малу частину: і протон, і нейтрон приблизно в 100 000 разів менші за весь атом! Для порівняння, уявімо, що ми збільшуємо ядро атома елемента водень (який має лише протон) до розміру тенісного м'яча, найближчий електрон буде приблизно в трьох кілометрах від відстань! Навіть якби атом був збільшений до висоти 14-поверхової будівлі, його серцевина мала би розмір простого зерна солі на сьомому поверсі. Це справді щось дивовижне, вам не здається ?!
* Електросфера: Є область, де електрони обертаються навколо ядра. Незважаючи на те, що область є значно більшим об’ємом, ніж ядро, вона практично порожня, оскільки кожен електрон у 1836 разів менше 1 протона (або ніж 1 нейтрон). Ось чому маса атома практично вся в ядрі. Електрони - це частинки з негативним електричним зарядом (-1).
Електрони були відкриті в 1897 р Джозеф Джон Томсон (1856-1940), творець Атомна модель Томсона. Експеримент Томсона можна детально побачити в тексті Експеримент Томсона з електричними розрядами, але коротше, він використав вищезгадану ампулу Крукса і зрозумів, що катодні промені були завжди залучений позитивним полюсом, який довів, що атом мав негативні частинки, які називали електрони.
Електрони обертаються навколо ядра мільярди разів на мільйонну частку секунди, формуючи атом і змушуючи його поводитися так, ніби він твердий.
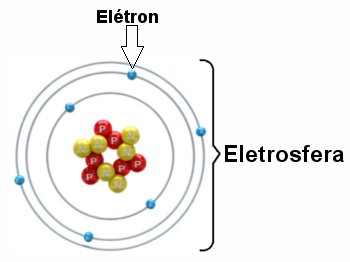
Ілюстрація електросфери з трьома електронними шарами та електронами, що обертаються навколо ядра.
Коротко, ми можемо скласти таблицю, щоб розрізнити три основні субатомні частинки, що входять до структури атома:

Маса та електричний заряд трьох основних субатомних частинок - протонів, нейтронів та електронів
Атоми всіх хімічних елементів складаються з цих трьох субатомних частинок. Те, що відрізняє один хімічний елемент від іншого, - це кількість, у якій з’являються ці частинки, особливо кількість протонів в ядрі, яке називається атомним номером. Продовжуйте вивчати це за допомогою тексту. Хімічний елемент.
* Карта розуму від мене. Діого Лопес
Дженніфер Фогача
Закінчив хімію
Хімія
Класифікація речовин, води, синильного газу, вуглекислого газу, аміаку, водню, гелію, речовин прості, складні речовини, суміші, фази суміші, однорідна суміш, суміш неоднорідний.