О хлористий натрій (кухонна сіль) - це сіль, яку ми використовуємо у своєму повсякденному житті для соління ручної або обробленої (промислової) їжі. Це речовина, яка також присутня в різних натуральних продуктах харчування, які ми споживаємо щодня, таких як фрукти, овочі, бобові, насіння тощо.
У цьому тексті ви будете знати все про цю важливу для повсякденного життя речовину:
визначення
Хлорид натрію належить до неорганічної функції солей і складається з асоціації катіона натрію (Na+) це аніон cтаморето (Кл-) через a іонний зв’язок.
б) Хімічні характеристики
Хлорид натрію утворюється двома хімічними елементами:
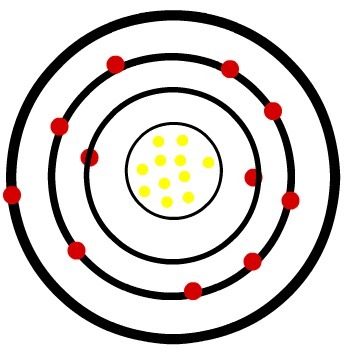
→ Натрій (Na):
належить до сімейства металів (здатних легко утворювати катіони) лужних (ШІ);
має електрон у валентній оболонці;
має атомний номер, рівний 11;
має високу електропозитивність (здатність втрачати електрони).
→ Хлор (Cl)
належить до сімейства галогенів (VIIA);
це неметал (тому він так легко стає аніоном);
має сім електронів у валентній оболонці;
має атомний номер, що дорівнює 17;
має високу електронегативність (здатність набирати електрони).
Оскільки два хімічні елементи, які утворюють хлорид натрію, мають, відповідно, високу та високу електропозитивність електронегативність, між ними існує іонний зв’язок (встановлюється між атомами з тенденцією до втрати та виграшу електрони).
Хімічна структура хлориду натрію складається з одного хлористого аніона (зелена куля), який взаємодіє з шістьма катіонами натрію (сині сфери), як видно з наведеної нижче структури:

Уявлення про кристалічну структуру хлориду натрію
в) Фізичні характеристики
Точка плавлення:
Хлорид натрію може перетворюватися з твердого стану в рідкий за температури 801 ОÇ.
Точка кипіння:
Хлорид натрію може перетворюватися з рідкого в газоподібний стан при температурі 1465 ОÇ.
Полярність
Оскільки це речовина, що походить від іонного зв’язку, тобто, оскільки це іонна сполука, хлорид натрію є полярним.
Розчинність у воді
Ми можемо розчинити в 1 л води при 25 ОС, до 359 грамів хлориду натрію.
Розчинність в інших розчинниках:
Оскільки хлорид натрію є полярною сполукою, його не можна розчиняти в будь-якому розчиннику неполярної природи, такому як олія.
Щільність:
Щільність хлориду натрію становить 2,165 г / мл, отже, він щільніший за воду, яка має щільність, рівну 1 г / мл.
Електропровідність:
Оскільки це іонна сполука, хлорид натрію здатний проводити електричний струм лише тоді, коли:
-
Він знаходиться в розплавленому стані, тобто в рідині;
Не зупиняйтесь зараз... Після реклами є ще щось;)
Розчиняється у воді.
г) Методи отримання
Хлорид натрію можна отримати фізично або хімічно:
1О) Отримання фізичного:
фракційна кристалізація
Хлорид натрію отримують випаровуванням води з океанів.
підземні шахти
Видобувається на шахтах за допомогою гірничих технік.
підземні родовища
Його видобувають із глибоких підземних відкладень, розчиняючи у воді (сіль, що міститься в родовищі, розчиняється) і згодом перекачуючи.
2О) Отримання хімічним способом
реакція синтезу
Отримання хлориду натрію можна здійснити в результаті хімічної реакції синтезу (прості речовини дають початок сполучній речовині) між газоподібним хлором та металевим натрієм:
2 дюйма(s) + Кл2 (г) → 2 NaCl(s)
Реакція нейтралізації:
Іншим способом хімічного отримання хлориду натрію є реакція нейтралізації між соляною кислотою та гідроксидом натрію, при якій ми утворюємо сіль і воду:
HCl(1) + NaOH(тут) → NaCl(тут) + H2О(1)
д) Важливість для людини
Хлорид натрію сам по собі не має функції в організмі людини, але коли він дисоціює на катіони натрію (Na+) і хлоридні аніони (Cl-), кожен з цих двох іонів виконує кілька важливих для нашого організму функцій. Перегляньте деякі з цих функцій:
→ Функції катіона натрію (Na+)
Запобігає згортанню крові;
Бореться з утворенням каменів у нирках і жовчному міхурі;
Бере участь у регуляції рідин організму;
Бере участь у регуляції артеріального тиску.
→ Функції хлоридного аніона (Cl-)
Участь у формуванні та конституції шлункового соку (хлористого-воднева кислота - HCl);
Участь у утворенні панкреатичного соку.
е) Пошкодження організму людини
Надмірне споживання хлориду натрію може завдати людям такої шкоди:
→ Пошкодження, спричинені надлишком катіонів натрію в організмі:
Збільшення часу загоєння ран;
Збільшення захворюваності на судоми;
Підвищений артеріальний тиск;
Перевантаження нирок;
Підвищений затримка рідини в організмі.
→ Пошкодження, спричинені надлишком хлоридних аніонів в організмі:
знищення вітамін Е;
Зниження вироблення йоду в організмі.
g) Інші програми
Окрім того, що хлорид натрію використовується для соління їжі, він також може застосовуватися в таких ситуаціях:
Виробництво шампуню;
Виробництво паперу;
Виробництво Їдкий натр (NaOH);
Виробництво миючих засобів;
Виробництво мила;
Танення снігу в місцях, які страждають від хуртовин;
Виробництво металевого натрію;
Видобуток хлорного газу;
В ізотоніках для заміщення електролітів в організмі;
В розчинах для знезараження носа;
Виробництво сольового розчину; серед інших додатків.
Мені Діого Лопес Діас
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
ДНІ, Діоґо Лопес. «Хлорид натрію (кухонна сіль)»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. Доступ 27 червня 2021 року.
Іонні сполуки, основні характеристики іонних сполук, зв'язок між іонами, остаточний перенос електронів, електростатичні сили притягання між іонами, негативні та позитивні іони, аніони, катіони, іонний зв’язок, молекулярна структура він
Хімія

Іонний зв’язок, домовленості між іонними сполуками, іонними агломератами, хлоридом натрію, кухонною сіллю, іонною речовиною, електростатичні сили притягання, хлоридні аніони, катіони натрію, полярні розчинники, позитивні іони, катіони, негативні іони, аніони.