Поняття оборотних та незворотних процесів можна описати математично, використовуючи поняття ентропії. Але перш ніж ми дійдемо до визначення ентропії, давайте перейдемо до понять оборотних та незворотних процесів. ми називаємо оборотний процес такий, при якому система може спонтанно повернутися до початкової ситуації (або стану). Незворотний процес це система, система якої не може спонтанно повернутися до свого початкового стану.
Оскільки поняття типів процесів уже були згадані, перейдемо до визначення ентропії. THE ентропія системи (S) - міра ступеня її дезорганізації. Чим більша організація, тим менша ентропія. Ентропія є характеристикою термодинамічного стану, як і внутрішня енергія, об’єм та кількість родимок.
Переглядаючи контейнери на малюнку вище, ми бачимо, що контейнер 1 має a ентропія менший за інший. Якщо ми візьмемо контейнер і струсимо його, ми перевіримо, що «кульки» змішані, точніше, дезорганізовані. Якщо ми перевіримо контейнер 2, струсивши його, ми помітимо, що кульки неможливі, спонтанно, поверніться до своєї початкової організації, якщо ми продовжуватимемо трястись контейнер.
У оборотних ізотермічних (температура яких завжди залишається незмінною) оборотних процесів ми визначаємо ентропію як відношення теплоти (даної або отриманої) до температури. Таким чином, ми представляємо ентропію в ізотермічних процесах таким чином:
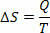
У Міжнародній системі одиниць ми вимірюємо ентропію в джоулях / кельвінах. Виходячи з концепції, яку ми описуємо про ентропію, ми можемо сформулювати Другий закон наступним чином:

Зміна ентропії ізольованої системи завжди є позитивною або нульовою. Рівність ΔS = 0 виникає, коли процеси оборотні: оборотні процеси не збільшують ентропію. Ізольовані системи, які ні отримують, ні передають тепло в навколишнє середовище, можуть лише збільшити або зберегти свою ентропію.
Доміціано Маркес
Закінчив фізику
Шкільна команда Бразилії
Джерело: Бразильська школа - https://brasilescola.uol.com.br/fisica/entropia-segunda-lei.htm
