Ö oksidasyon-indirgeme denkleminin dengelenmesi verilen elektron sayısı ile alınan elektron sayısının eşitliğine dayanır. Bu dengelemeyi gerçekleştirmenin basit bir yöntemi aşağıdaki adımlarla verilmektedir:
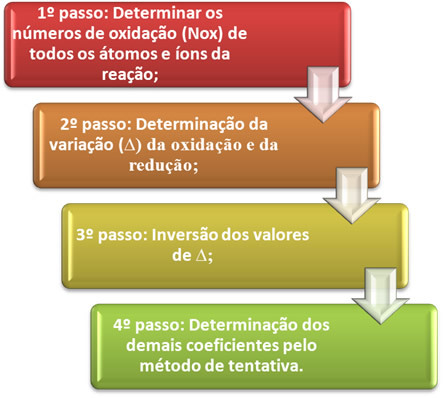
Aşağıdaki örnek üzerinden bu adımların nasıl uygulanacağını pratikte görelim:
Sulu bir potasyum permanganat çözeltisi ile hidroklorik asit arasındaki reaksiyon:
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2Ö
*1. adım:Oksidasyon numaralarını belirleyin:
Bu adım önemlidir, çünkü genellikle hangi türlerin oksidasyona ve azalmaya uğradığını hızlı bir şekilde görselleştiremeyiz.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2Ö
*2. adım:Oksidasyon ve indirgeme varyasyonunun belirlenmesi:

Manganezin (Mn) indirgendiğini ve klorin (Cl) oksitlendiğini unutmayın.
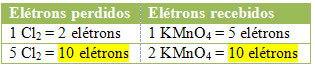
MnCl2 = ∆Nox = 5
Cl2 = ∆Nox = 2
Klor durumunda, HCl'nin 3 bileşiğe (KCl, MnCl) yol açtığını not edebiliriz.2ve Cl2), ama bizi ilgilendiren Cl2, çünkü varyasyona maruz kalan sizin Nox'unuzdur. Cl oluşturan her klor2 1 elektron kaybetmek; her bir Cl'yi oluşturmak için 2 klorun nasıl gerekli olduğu2, sonra iki elektron kaybolur.
3. adım:∆ değerlerinin tersine çevrilmesi:
Bu adımda, ∆ değerleri belirtilen türler arasında değiştirilir ve katsayıları olur:
MnCl2 = ∆Nox = 5 → 5 Cl katsayısı olacak2
Cl2 = ∆Nox = 2→ 2 MnCl katsayısı olacak2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2Ö
Bu noktada, denklemin iki katsayısını bilmek zaten mümkündür.
Gözlem: normalde, çoğu reaksiyonda, bu değerlerin tersine çevrilmesi 1. üyede gerçekleştirilir. Ancak genel bir kural olarak bu, redoksa uğrayan en fazla sayıda atoma sahip olan üyede yapılmalıdır. Bu kriter sağlanamıyorsa, en fazla kimyasal türe sahip üye için değerleri tersine çeviriyoruz. 2. üye daha fazla maddeye sahip olduğu için burada yapılan budur.
Şimdi durma... Reklamdan sonra devamı var ;)
4. adım: Deneme dengelemesi:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2Ö
- İkinci elemanda, katsayı ile gösterildiği gibi iki manganez atomu bulunduğundan, ilkinde de olması gerekir. Böylece sahibiz:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2Ö
- Böylece, 1. üyedeki potasyum (K) miktarı, ikinci üyedeki bu atom için aynı katsayı olacak olan 2 idi:
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2Ö
- 2. üyedeki klor (Cl) miktarı toplamda 16 olduğundan 1. üyenin HCl katsayısı şöyle olacaktır:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2Ö
- 1. üyedeki hidrojen sayısı 16'dır, dolayısıyla su katsayısı (H22. üyenin O) hidrojen indeksinin (2) 8 ile çarpımı 16'ya eşit olduğundan, 8'e eşit olacaktır:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2Ö
- Denklemin doğru şekilde dengelenip dengelenmediğini kontrol etmek için iki kriter görebiliriz:
1.) İki üyedeki her atomun miktarının eşit olup olmadığını kontrol edin:
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5 Cl2 + 8 Saat2Ö
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2.) Kaybedilen toplam elektron sayısının alınan toplam elektron sayısına eşit olup olmadığına bakın:
Jennifer Foğaça tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Roxi azaltma dengelemesi"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. 28 Haziran 2021'de erişildi.



