at Kimyasal bağlar bir bileşiğin molekülü veya temel maddesi haline gelmek için atomlar arasında meydana gelen etkileşimlerdir. Üç tür bağlantı vardır: kovalent, metalik ve iyonik. Atomlar, kimyasal bir bağ kurarak kendilerini elektronik olarak stabilize etmeye çalışırlar. Bu süreç şu şekilde açıklanmaktadır: sekizli teorisiBu, kararlılığa ulaşmak için her atomun değerlik kabuğunda sekiz elektrona sahip olması gerektiğini belirtir.
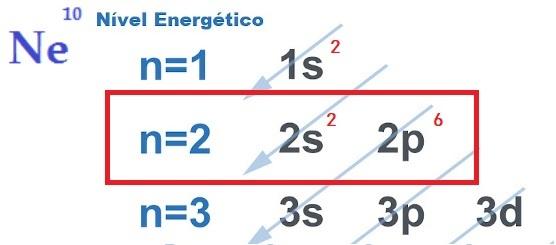
Kimyasal Bağlar ve Oktet Kuralı
bu elektronik kararlılık için arama, atomlar arasındaki kimyasal bağların gerçekleşmesini haklı kılan, şu şekilde açıklanmaktadır: sekizli teorisi. Newton Lewis tarafından önerilen bu teori, atomik etkileşimin, her elementin bir soy gazın kararlılığını kazanması için gerçekleştiğini, yani, sekiz elektron değerlik katmanı.
Bunun için eleman vermek, almak veya paylaşmak elektronları en dış kabuğundan çıkarır, bu nedenle iyonik, kovalent veya metalik karakterde kimyasal bağlar kurar. Sen soy gazlar en dış kabuğunda zaten sekiz elektronu olan tek atomlardır ve bu yüzden diğer elementlerle çok fazla reaksiyona girmezler.
BakAyrıca: Elektronik dağıtım kuralları: nasıl yapılır?
Kimyasal bağ türleri
Oktet kuralında tahmin edildiği gibi değerlik kabuğundaki sekiz elektronu elde etmek için atomlar birbirine bağlanır, elektron verme, alma veya paylaşma ihtiyacına ve ayrıca bağlanan atomların doğasına göre değişir.
iyonik bağlar
Ayrıca şöyle bilinir elektrovalent veya heteropolar bağlar, arasında olur metaller ve çok elektronegatif elementler (ametaller ve hidrojen). Bu arama türünde, metaller elektron kaybetme eğilimindedir, katyonlara dönüşme (pozitif iyonlar), ve metal olmayanlar ve hidrojen elektron kazanır, anyonlar (negatif iyonlar) haline gelir.
Sen iyonik bileşikler sert ve kırılgandır, yüksek kaynama noktasına ve davranışa sahiptir elektrik akımı sıvı halde olduklarında veya suda seyreltildiklerinde.
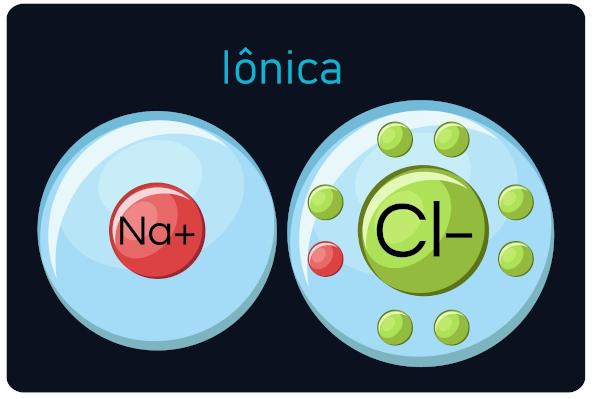
Gözlem: Elektron kazanan atomun negatif işaretli bir iyon olacağını ve elektron kaybeden atomun pozitif bir işaret olacağını unutmayın.
İyonik maddelere örnekler:
- Bikarbonat (HCO3-);
- Amonyum (NH4+);
- Sülfat (SO4-).
Bu tür kimyasal bağ hakkında daha fazla bilgi edinmek için metnimizi ziyaret edin: iyonik bağlar.
kovalent bağlar
at kovalent bağlar tarafından meydana elektron paylaşımı. Bağlayıcı elementler arasındaki düşük elektronegatiflik farkı nedeniyle elektron vermez veya almazlar, ancak elektronik çiftleri paylaş oktet kuralına göre kararlı olmaları için. Bu tür bağlantı, Cl gibi basit elemanlarda çok yaygındır.2, H2, Ö2ve ayrıca karbon zincirlerinde. farkı elektronegatiflik Ligandlar arasındaki bağın polar mı yoksa polar olmayan mı olduğunu belirler.

Siz de okuyun:Moleküllerin polaritesi: nasıl belirlenir?
datif kovalent bağ
Olarak da adlandırılır koordinat kovalent bağ, semipolar, datif veya koordinat bağı, kovalent bağa çok benzer, ikisi arasındaki fark, datif bağdaki atomlardan birinin iki elektronu paylaşmaktan sorumlu olmasıdır. Bu bağlantı türünde, yapay olarak oluşurmolekül, kendiliğinden oluşan bir kovalent bağdan kaynaklanan bir molekül ile aynı özellikleri kazanır.
Metal bağlantılar
Bu tür bağ metaller arasında olur.1A (alkali metaller), 2A (alkali toprak metalleri) ve geçiş metalleri (periyodik tablonun B bloğu - grup 3 ila 12) ailesinin elemanlarını içeren, bizim dediğimiz şeyi oluşturan metal alaşımları. Diğer bağlantı türlerine göre diferansiyel özellik, elektron hareketiBu, katı haldeki metalik malzemelerin mükemmel elektriksel ve termal iletkenler olduğu gerçeğini açıklar. Ayrıca metalik alaşımlar yüksek bir erime ve kaynama noktasına, sünekliğe, dövülebilirliğe ve parlaklığa sahiptir. Metal alaşımlarına örnekler:
çelik: demir (Fe) ve karbon C;
bronz: bakır (Cu) + kalay (Sn);
pirinç: bakır (Cu) + çinko (Zn);
altın: altın (Au) + bakır (Cu) veya gümüş (Ag).

Özet
- Kimyasal bağlar: elektronik kararlılık arayan atomlar arasındaki etkileşim.
- Çağrı türleri: iyonik, kovalent ve metalik.
- Oktet Kuralı: atomun kararlı olması için değerlik kabuğunda sekiz elektrona sahip olması gerektiğini tanımlar.
çözülmüş alıştırmalar
soru 1 - (Mackenzie-SP) Kükürt ve potasyum atomlarının bir soy gazınkine eşit bir elektronik konfigürasyon elde etmesi için aşağıdakiler gereklidir:
(Veri: atom numarası S = 16; K = 19).
a) Kükürt 2 elektron alır ve potasyum 7 elektron alır.
b) kükürt 6 elektron verir ve potasyum 7 elektron alır.
c) kükürt 2 elektron verir ve potasyum 1 elektron verir.
d) Kükürt 6 elektron alır ve potasyum 1 elektron verir.
e) Kükürt 2 elektron alır ve potasyum 1 elektron verir.
çözüm
Alternatif E. Sülfür 6A veya 16 ailesinde olduğundan, oktet kuralına uyarak değerlik kabuğunda 8 olması için 2 elektron alması gerekir. Öte yandan, periyodik tablonun ilk ailesine (1A veya hidrojen ailesi) ait olan potasyumun değerlik katmanında soy gaz konfigürasyonuna sahip olması için 1 elektron kaybetmesi gerekir. 2 potasyum atomunu 1 kükürt atomuyla birleştirerek, her iki elementin de elektriksel olarak kararlı olduğu bir iyonik bağ kurabiliriz.
soru 2 - (UFF) Anne sütü proteinler, yağlar ve şekerler gibi organik maddeler ve kalsiyum fosfat gibi mineral maddeler açısından zengin bir besindir. Bu organik bileşiklerin ana özelliği, moleküllerinin oluşumunda kovalent bağlara sahipken, mineralde de iyonik bir bağ vardır. Sırasıyla kovalent ve iyonik bağ kavramlarını doğru bir şekilde sunan alternatifi kontrol edin:
a) Kovalent bağ sadece organik bileşiklerde oluşur.
b) Kovalent bağ elektron transferi ile, iyonik bağ ise zıt spinli elektronlar paylaşılarak yapılır.
c) Kovalent bağ, atomlar arasındaki yüklerin çekimi ile ve iyonik bağ, yük ayrımı ile yapılır.
d) Kovalent bağ, moleküllerdeki atomların birleştirilmesiyle, iyonik bağ ise kimyasal komplekslerdeki atomların birleştirilmesiyle yapılır.
e) Kovalent bağ elektron paylaşımı ile, iyonik bağ ise elektron transferi ile yapılır.
çözüm
Alternatif E.
Diğerlerine bakalım:
- Alternatif olarak: yanlış, çünkü CO gibi inorganik bileşiklerde de kovalent bağlar oluşur.2.
- Alternatif b: kovalent bağlar paylaşılarak ve iyonik bağlar elektron transferi ile oluştuğu için yanlış.
- Alternatif c: Hem kovalent bağ hem de iyonik bağ, çekirdekler arasındaki elektrostatik çekim yoluyla değil, elektronları kaybetme veya kazanma ihtiyacıyla gerçekleşir.
- Alternatif d: Hem kovalent hem de iyonik olan her iki bağ da bir moleküldeki atomların birleşmesiyle oluşur.
Soru 3 - (PUC-MG) Ortam koşullarında X, Y ve Z olmak üzere üç maddenin özelliklerini gösteren tabloyu inceleyin.
| Madde | Erime sıcaklığı (c°) | elektiriksel iletkenlik | sudaki çözünürlük |
| x | 146 | Yok |
çözünür |
| y | 1600 | yüksek | çözünmez |
| z | 800 | sadece erimiş veya suda çözülmüş | çözünür |
Bu bilgileri göz önünde bulundurarak X, Y ve Z maddelerinin sırasıyla şöyle olduğunu söylemek DOĞRU olacaktır:
a) iyonik, metalik, moleküler.
b) moleküler, iyonik, metalik.
c) moleküler, metalik, iyonik.
d) iyonik, moleküler, metalik.
çözüm
Alternatif C.
X Maddesi molekülerdir, moleküler bağlar olarak kovalent olarak da adlandırılır, Ligandlar arasındaki elektronegatiflik farkı olmadığı için düşük kaynama noktasına sahiptir. çok uzun. Genellikle kovalent bileşiklerin elektriksel iletkenliği yoktur ve çözünürlük değişkendir.
Metallerin yüksek bir erime noktasına sahip olmaları, mükemmel elektrik iletkenleri olmaları ve suda çözünmemeleri nedeniyle Y maddesini metalik olarak tanıyabiliriz.
Son olarak, molekülün kristal düzeninin bir sonucu olarak bu madde için erime noktası nispeten yüksek olduğundan, Z maddesi iyoniktir. İyonik bir madde suda veya sıvı halde çözüldüğünde, serbest iyonlara sahiptir, bu da onu elektron iletken ve suda çözünür hale getirir.
Laysa Bernardes Marques tarafından
Kimya hocası
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/ligacoes-quimicas.htm


