Kimyasal reaksiyonların hızını ve onu etkileyen faktörleri inceleyen bir bilim dalı vardır, buna Kimyasal Kinetik denir. Kimyasal reaksiyonlar, iki veya daha fazla maddenin birbiriyle reaksiyona girerek farklı bileşiklere yol açtığı bir dizi olay olarak tanımlanabilir. Bir kimyasal denklem, ilk üyede reaktanların ve ikincisinde ürünlerin göründüğü bir kimyasal reaksiyonun grafiksel bir temsilidir.
A + B  C + D
C + D
Reaktifler Ürünler
Reaksiyonların bilgisi ve incelenmesi endüstriyel anlamda çok önemli olmasının yanı sıra günlük hayatımızla da ilgilidir.
Bir reaksiyonun hızı, reaktanların ne kadar hızlı tüketildiği veya ürünlerin ne kadar hızlı oluştuğudur. Bir mumun yanması ve pas oluşumu yavaş reaksiyon örnekleridir. Dinamitte nitrogliserinin ayrışması hızlı bir reaksiyondur.
Kimyasal reaksiyonların hızları, yasaları denilen ampirik yasalarla belirlenir. Reaktantların ve ürünlerin konsantrasyonunun reaksiyon hızı üzerindeki etkisinden elde edilen hız reaksiyon.
Kimyasal reaksiyonlar farklı hızlarda meydana gelir ve bunlar değiştirilebilir, çünkü reaktanların ve ürünlerin konsantrasyonu, reaksiyon hızları diğer faktörlere de bağlıdır sevmek:
reaktif konsantrasyonu: Reaktanların konsantrasyonu ne kadar yüksek olursa, reaksiyon o kadar hızlı olur. İki veya daha fazla madde arasında bir reaksiyonun gerçekleşmesi için moleküllerin çarpışması gerekir, böylece bağlarda bir kopukluk olur ve bunun sonucunda yenilerinin oluşumu gerçekleşir. Çarpışma sayısı A ve B konsantrasyonlarına bağlı olacaktır. Resme bakın:
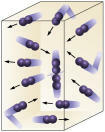
Moleküller daha sık çarpışırsa
reaksiyona giren moleküllerin sayısını arttırırız.
Daha yüksek konsantrasyon nedeniyle moleküller arasındaki çarpışmalarda bir artış olacağını görmek kolaydır.
temas yüzeyi: temas yüzeyindeki bir artış reaksiyon hızını arttırır. Bir örnek, ezilmiş bir sonrisal tableti çözdüğümüzde ve tabletin daha hızlı çözülmesidir. bütünden daha, bu, reaksiyona giren temas yüzeyini arttırdığımız için olur. Su.
Basınç: gazlı bir sistemin basıncını artırdığınızda, reaksiyon hızı artar.
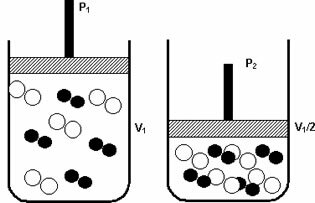
Basınçtaki P1'den P2'ye bir artış, hacmi V1'den V1/2'ye düşürerek, moleküllerin yaklaşması nedeniyle reaksiyonu hızlandırdı.
Yukarıdaki şekil, ikinci kaptaki hacim azalmasıyla olduğu gibi, hacimde bir artış olacağını örneklemektedir. Moleküllerin çarpışmasını yoğunlaştıran basınç ve sonuç olarak moleküllerin hızında bir artış reaksiyon.
Sıcaklık: Bir sistemin sıcaklığı artırıldığında, reaksiyon hızında da bir artış olur. Sıcaklığı artırmak, moleküllerin kinetik enerjisini artırmak anlamına gelir. Her gün yemek pişirirken bu faktörü gözlemleyebiliriz ve yemeğin daha hızlı pişme derecesine ulaşması için ocağın alevini yükseltiriz.
Katalizörler: Katalizörler kalıcı değişime uğramadan mekanizmayı hızlandıran yani reaksiyon sırasında tüketilmeyen maddelerdir. Katalizörler, reaksiyonun daha az aktivasyon enerjisi gerektiren alternatif bir yol izlemesine izin vererek reaksiyonun daha hızlı ilerlemesine neden olur. Bir katalizörün reaksiyonu hızlandırdığını, ancak verimi artırmadığını, yani aynı miktarda ürünü daha kısa sürede ürettiğini hatırlamak önemlidir.
Líria Alves tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm
