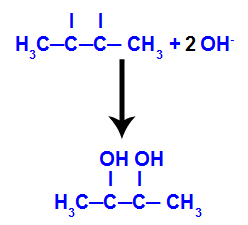
Yanma, enerjinin ısı şeklinde serbest bırakıldığı iki reaktif, yakıt ve oksitleyici arasındaki ekzotermik bir kimyasal reaksiyondur.
- Yakıt: Yanmayı beslemekten sorumlu oksitlenebilen maddedir. Örnekler: benzin, odun, pişirme gazı, alkol ve dizel.
- oksitleyici: Yanmayı arttıran maddedir. Çoğu durumda oksitleyici oksijen O gazıdır.2.
Yanma sadece yakıt ve oksitleyici varlığında gerçekleşir. Bu nedenle, yalnızca bu reaktiflerden birinin olmaması nedeniyle sonlandırılır veya kesintiye uğrar.
Yanma günlük yaşamda çok yaygındır, diğerlerinin yanı sıra yemek pişirme gazlarının, otomobil yakıtlarının, mumların, odunun, kağıdın yakılmasında bulunur.
 Odun yakmak bir yanma örneğidir.
Odun yakmak bir yanma örneğidir.
Türler
Organik bileşikler, tam ve eksik olmak üzere iki tür yanmaya sahiptir.
Tam yanma
Tam yanma, yakıtı tüketmek için yeterli oksijene sahip olandır. ürünler olarak sunmaktadır. CO2 (Karbon dioksit) ve H2Ö (Su).
Tam yanma daha fazla ısı salınımına sahiptir.
Örnekler:
a) Etanolün tam yanması (C2H6Ö):
Ç2H6O+O2 → CO2 + H2Ö
Reaksiyonu dengelerken:
Ç2H6O + 3 O2 → 2 CO2 + 3 Saat2Ö
Bu reaksiyonda, oksijen miktarı tüm metanolün tüketilmesi için yeterliydi ve CO2 ürünleri olarak ortaya çıktı.2 ve H2Ö.
b) Metanın tam yanması (CH4):
CH4 + O2 → CO2 + H2Ö
CH4 + O2 → CO2 + 2 Saat2Ö
Eksik yanma
Eksik yanmada yakıtı tamamen tüketmek için yeterli oksijen yoktur.
İki tür ürünü vardır: CO (Karbonmonoksit) veya kurum (C), çevreye toksik ve sağlığa zararlı maddeler.
Eksik yanma daha az ısı salınımına sahiptir.
Örnekler:
a) Etanolün eksik yanması:
Ç2H6O + 2 O2 → 2 CO + 3 H2O = CO ve H üretimi2Ö.
Ç2H6O+O2 → 2C + 3H2O = Kurum ve H üretimi2Ö.
İki reaksiyon arasında oksijen miktarında bir azalma olduğuna dikkat edin, bu, salınan daha az miktarda ısıyı temsil eder.
b) Metanın eksik yanması:
CH4 + 3/2 O2 → CO + 2 H2Ö
CH4 + O2 → C + 2 H2Ö
sen de oku:
- Oksidasyon
- kimyasal reaksiyonlar
- Endotermik ve ekzotermik reaksiyonlar
- termokimya
yanma entalpisi
Yanma entalpisi (H) veya yanma ısısı, standart durum koşullarında (Sıcaklık: 25 °C; Basınç: 1 atm).
Yanma ekzotermik bir reaksiyon olduğundan, entalpi değişimi (∆H) her zaman negatif bir değere sahip olacaktır.
Yanma entalpisi aşağıdaki formül kullanılarak hesaplanabilir:
ΔH = HÜrün:% s -Hreaktifler
İçten yanma
Kendiliğinden yanma, harici bir yanıcı kaynağın varlığı olmadan gerçekleşen yanmadır.
Bu, içlerinde çok fazla ısı biriktirebilen ve kimyasal reaksiyonların hızını artıran bazı malzemelerle olur. Bu durum, yanma gerçekleşene kadar malzemenin sıcaklığını arttırır.
hala kanıt var kendiliğinden insan yanması (CHE), vücudun herhangi bir dış kaynaktan etkilenmeden yandığı.
Bu vakanın ilk kaydı, 1663'te uyurken bir kadının başına gelebilirdi. Diğer benzer vakalar da kendiliğinden insan yanması ile ilgiliydi.
Bununla birlikte, bilim hala sürecin insan vücudunda nasıl gerçekleştiğini anlamaya çalışıyor. Şu anda, fenomeni açıklamak için sadece birkaç teori var.
Ayrıca bakınız: Ateş