bizde bir var kimyasal reaksiyon olmadan farklı çözünenlerle çözeltilerin karıştırılması ortak olarak aynı iyona sahip maddelere sahip iki veya daha fazla karışım olduğunda (aynı katyon veya aynı anyon). Aşağıdaki örnekte olduğu gibi:
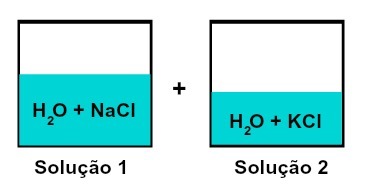
Farklı çözünenlere sahip çözeltilerin karışımı
1. solüsyon su ve sodyum klorürdür (NaCl), 2. solüsyonda su ve potasyum klorür (KCl) bulunur. Birlikte karıştırıldığında elimizde bir kimyasal reaksiyon olmadan farklı çözünen çözeltilerin karıştırılması, çünkü kullanılan her iki tuz da klorür anyonuna sahiptir (Cben-).
1- Kimyasal reaksiyon olmadan farklı çözünen çözeltilerin karışımlarının özellikleri
Kimyasal reaksiyon olmaksızın farklı çözünenlere sahip bir çözelti karışımı yapıldığında, aşağıdaki özellikler her zaman kontrol edilir:
Çözünenlerin her birinin kütlesi değişmez (eğer çözelti 1'de 10 g çözünen varsa ve 2, 30 g'da örneğin karıştırıldıktan sonra her çözünen aynı kütleye sahip olacağız),
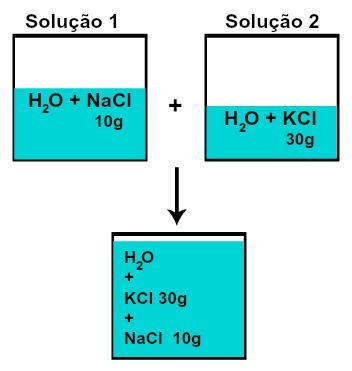
Çözeltileri kimyasal reaksiyon olmadan karıştırdıktan sonra çözünenlerin her birinin kütlesi
bu madde miktarı (n) çözünenlerin her biri değişmez (eğer solüsyon 1'de 5 mol çözünen varsa ve 2,4 mol'de örneğin karıştırıldıktan sonra her birinden aynı miktarda maddeye sahip olacağız),
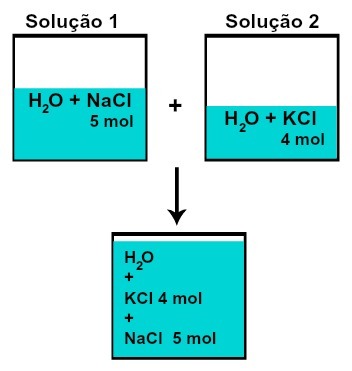
Kimyasal reaksiyon olmadan çözeltileri karıştırdıktan sonra çözünenlerin her birinin mol sayısı
Nihai çözümün hacmi, VF, karıştırılan çözeltilerin her birinin hacimlerinin toplamının sonucudur (1. çözeltide 200 mL ve 2. çözeltide 300 mL ise, örneğin karıştırıldıktan sonra 500 mL hacme sahip olacağız),
VF = V1 + V2
2- Farklı çözünenlerin çözeltilerinin kimyasal reaksiyon olmadan karıştırılmasının hesaplanmasında kullanılan formüller.
Bu tip karışımda olduğu gibi, sadece her birine göre çözücü miktarında bir artışa sahibiz. çözünenler, aşağıdakileri kullanarak çözünenlerin her birinin nihai konsantrasyonunu hesaplamalıyız. ifade:
a) ortak konsantrasyon (Ç)
Çözüm 1 için, çözelti 1 konsantrasyonunun hacmiyle çarpımı, hacmiyle çarpılan nihai konsantrasyona eşittir.
Ç1.V1 = CF.VF
2. Çözüm için: 2. çözeltinin konsantrasyonunun hacmiyle çarpımı, hacmiyle çarpılan nihai konsantrasyonun değerine eşittir.
Ç2.V2 = CF.VF
b) madde veya molarite miktarındaki konsantrasyon (E)
1. çözüm için:
M1.V1 = MF.VF
2. çözüm için:
M2.V2 = MF.VF
c) Çözeltide bulunan her iyonun madde miktarındaki konsantrasyonu
Nihai çözeltide bulunan iyonların birinin veya tümünün konsantrasyonunu belirlememiz gerekiyorsa, şunları yapmalıyız:
1º: İyon konsantrasyonunun, geldiği çözünenin konsantrasyonunun (M), madde formülündeki indeksi ile çarpılmasıyla verildiğini unutmayın. Böylece, Y iyonu için, madde 1'de, XY3, konsantrasyon şöyle olacaktır:
[Y]1 = 3. M
Solute2, ZY'ye gelince, Y konsantrasyonu şu şekilde verilir:
[Y]2 = 1. M
2º: Aynı iyonu serbest bırakan birden fazla çözünen varsa, örneğin, XY çözünenleri3 ve aynı Y iyonuna sahip olan ZY, bu iyonun nihai çözeltideki konsantrasyonu, her çözünen için konsantrasyonlarının toplamı ile verilir:
[Y]F = [Y]1 + [Y]2
3- Farklı çözünen çözeltilerin kimyasal reaksiyon olmadan karıştırılmasını içeren hesaplama örnekleri
Örnek 1: (PUC SP) Bir beher içinde, 200 mL sulu bir kalsiyum klorür (CaCl) çözeltisi karıştırıldı.2) 0,5 mol konsantrasyonda. L–1 ve 300 ml 0.8 mol çözelti. L–1 sodyum klorür (NaCl). Elde edilen çözelti, yaklaşık olarak bir klorür anyon konsantrasyonuna sahiptir:
a) 0.34 mol. L–1
b) 0.65 mol. L–1
c) 0.68 mol. L–1
d) 0.88 mol. L–1
e) 1.3 mol. L–1
Tatbikatın sağladığı veriler şunlardı:
1. Çözüm:
Hacim (V1): 200 ml
Molar konsantrasyon (M1): 0,5 mol. L–1
2. Çözüm:
Hacim (V2): 300 ml
Molar konsantrasyon (M2): 0.8 mol. L–1
Klorür anyonlarının konsantrasyonunu belirlemek için (Cl-), şu adımları izlemeliyiz:
Aşama 1: nihai çözümün hacmini hesaplayın
VF = V1 + V2
VF = 200 + 300
VF = 500 ml
Adım 2: Nihai çözeltinin molar konsantrasyonunu CaCl çözünen maddesine göre hesaplayın2, aşağıdaki ifadeyi kullanarak:
M1.V1 = MF.VF
0,5,200 = MF.500
100 = MF.500
100 = MF
500
MF = 0.2 mol. L–1
Aşama 3: Klorür [Cl] molar konsantrasyonunu hesaplayın-]1, son çözeltide, CaCl çözünenden2, aşağıdaki ifadeyi kullanarak:
NOT: Formülde molaritenin 2 ile çarpımı var çünkü çözünen formül CaCl'de Cl'de 2 indeksimiz var2.
[Şl.-]1 = 2.MF
[Şl.-]1 = 2. 0,2
[Şl.-]1 = 0.4 mol. L–1
4. Adım: Aşağıdaki ifadeyi kullanarak, NaCl çözünen maddesine göre nihai çözeltinin molar konsantrasyonunu hesaplayın:
M2.V2 = MF.VF
0.8.300 = MF.500
240 = MF.500
240 = MF
500
MF = 0.48 mol. L–1
Adım 5: Molar klorür konsantrasyonunu hesaplayın, [Cl-]2, nihai çözümde, aşağıdaki ifadeyi kullanarak NaCl çözüneninden:
NOT: Formülde molaritenin 1 ile çarpımı var çünkü çözünen NaCl formülünde Cl'de 1 indeksimiz var.
[Şl.-]2 = 1.MF
[Şl.-]2 = 1. 0,48
[Şl.-]2 = 0.48 mol. L–1
6. Adım: Nihai çözeltideki toplam klorür iyonu miktarını hesaplayın
Bunu yapmak için, 3. ve 5. adımlarda çözünen maddelerin her biri için molar klorür konsantrasyonlarını eklemeniz yeterlidir:
[Şl.-]F = [Şl-]1+ [Şl-]2
[Şl.-]F = 0,4 + 0,48
[Şl.-]F = 0.88 mol. L–1
Örnek 2: 500 ml 6 mol/L KOH solüsyonuna 300 ml K solüsyonu eklendi.2SADECE3 3 mol/L. Elde edilen karışımdaki çözünenlerin her birinin konsantrasyonu nedir?
a) 3,75 ve 3,0 mol/L
b) 3.75 ve 1.215 mol/L
c) 4,5 ve 1,125 mol/L
d) 3.75 ve 1.125 mol/L
e) 4,5 ve 1.215 mol/L
Tatbikatın sağladığı veriler şunlardı:
1. Çözüm:
Hacim (V1): 500 ml
Molar konsantrasyon (M1): 6 mol. L–1
2. Çözüm:
Hacim (V2): 300 ml
Molar konsantrasyon (M2): 3 mol. L–1
Klorür anyonlarının konsantrasyonunu belirlemek için (Cl-), şu adımları izlemeliyiz:
Aşama 1: nihai çözümün hacmini hesaplayın
VF = V1 + V2
VF = 500 + 300
VF = 800 ml
Adım 2: Aşağıdaki ifadeyi kullanarak KOH çözünenine göre nihai çözeltinin molar konsantrasyonunu hesaplayın:
M1.V1 = MF.VF
6.500 = MF.800
3000 = MF.800
3000 = MF
800
MF = 3.75 mol. L–1
Aşama 3: Çözünen K ile ilgili olarak nihai çözeltinin molar konsantrasyonunu hesaplayın2SADECE3, aşağıdaki ifadeyi kullanarak:
M2.V2 = MF.VF
3.300 = MF.800
900 = MF.800
900 = MF
800
MF = 1.125 mol. L–1
Benden Diogo Lopes Dias
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm

