A elektrosfer atomun bulunduğu bölgedir elektronlar Bulunurlar. Elektrosfer, daha doğrusu, Schrödinger denkleminin çözülmesiyle belirlenen atomik yörüngelerden oluşur. İlk olarak Rutherford'un modeliyle belirlenen elektrosfer, Bohr'un atom modelinin geçerliliği sırasında önemli ilerlemeler kaydetti.
Elektronların tanımladığı (sürekli olmayan) enerji nedeniyle, elektrosfer katmanlara (veya enerji seviyelerine) bölünebilir. İki veya daha fazla elektrona sahip atomlar için kabuklar alt kabuklara (veya alt kabuklara) bölünür. Elektrosfer, atomun özelliklerinin anlaşılması ve kimyasal bağların oluşumunun anlaşılması açısından son derece önemlidir.
Siz de okuyun: Atom nasıl bölünür?
Elektrosfer hakkında özet
Elektrosfer, atomun elektronların bulunduğu bölgesidir.
Schrödinger denklemlerinin çözümü olan atomik yörüngeler ve dalga fonksiyonlarından oluşur.
Konsepti Ernest Rutherford'un modeliyle başladı.
Elektronlar atom çekirdeğine olan çekimleri nedeniyle elektrosferde tutulur.
Elektrosferin anlaşılmasındaki ana ilerlemeler, Niels Bohr'un modelinin tasarlanması sırasında meydana geldi.
Tanımlanmış enerji bölgeleri olan katmanlardan (veya enerji seviyelerinden) oluşur.
Birden fazla elektrona sahip atomlar için kabuklar alt kabuklara (veya alt kabuklara) bölünür.
Elektrosfer atomik benzerlik, kararlılık gibi çeşitli özellikleri anlamak için önemlidir. bağ oluşumunun anlaşılmasına ek olarak atom yarıçapı, iyonlaşma enerjisi, elektron ilgisi kimyasallar.
Elektrosferle ilgili video dersi
Elektrosfer nedir?
Elektrosfer şu şekilde tanımlanır: Atomik yapının elektronların bulunduğu bölgesi. Daha derinlemesine yorumlarda Schrödinger denkleminin çözümü olan atomik yörüngelerden, dalga fonksiyonlarından oluştuğunu söylüyoruz. Bir atomik yörüngenin matematiksel ifadesi, karesi alındığında, elektronun belirli bir noktadaki konumunun olasılık yoğunluğunu sunar.
Ö Elektrosfer kavramı ortaya çıkmaya başladı Ernest Rutherford'un atom modeliyoğun, pozitif bir çekirdeğin etrafında dönen elektronları içerir. Daha sonra Niels Bohr, kuantum mekaniğindeki kavramları karıştırarak elektrosfere ilişkin daha anlamlı yorumlar getirdi.
Elektrosferin katmanları
Elektronlar atom çekirdeğine olan çekimleri nedeniyle elektrosferde tutulur. Ancak bilinmektedir ki bunlar elektronlar enerjileri iyi tanımlanmış kabuklardadır. Bu tür katmanlara enerji seviyeleri de denilebilir.
Bu sonuca spektroskopi deneylerinden sonra ulaşıldı. Örneğin H gazına elektrik akımı uygulandığında2 Düşük basınçta ışık H tarafından yayılır.2. Bu durumda H iyonları oluşur+ ve H iyonlarına geri dönecek olan elektronlar+ ve heyecanlı (enerjili) H türleri oluşturacak+. Fazla enerjiyi gidermek için H iyonları+ Enerjiyi elektromanyetik radyasyon (ışık) formunda serbest bırakır ve H gazına yeniden birleştirir2 Tekrar.
Beyaz ışığın bir prizmadan geçtiğinde sürekli bir spektruma (gökkuşağına benzer) bölündüğünü hatırlayabilirsiniz; ancak H'den gelen ışıkta aynı durum söz konusu değildir.2: Böyle bir radyasyon prizmadan geçtiğinde, H emisyon spektrumunda yalnızca belirli bir dalga boyuna sahip parlak çizgiler gözlenir.2spektral çizgiler olarak bilinir.
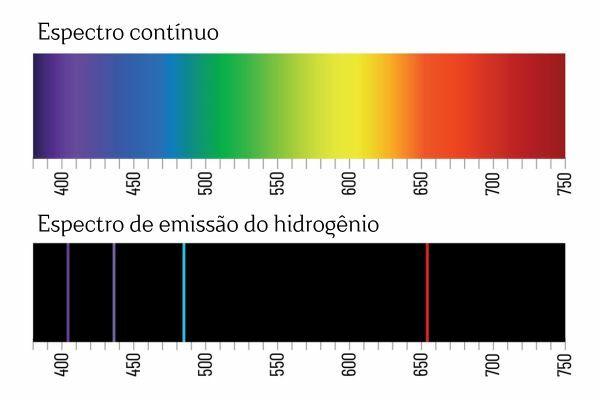
Elementlerin emisyon spektrumlarının (iyi tanımlanmış spektral çizgilerle) yorumu şu şekildedir: bir elektron, bir atomda, herhangi bir enerji sunamaz, bunun yerine iyi tanımlanmış miktarlarda (enerji paketleri denir). Eğer elektronların bu tür enerji kısıtlamaları olmasaydı, elementlerin emisyon spektrumu tıpkı bir prizmadan geçen beyaz ışık gibi sürekli olurdu.
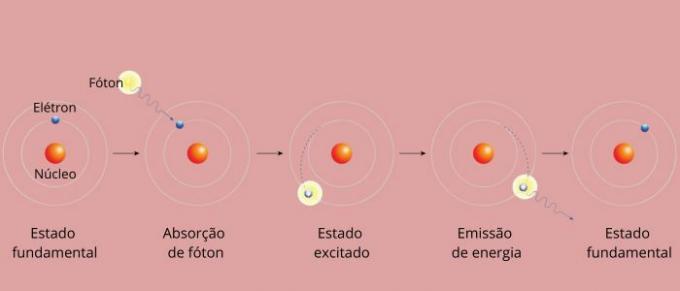
Bir elementin her spektral çizgisi, enerji seviyesi olarak bilinmeye başlandı. (veya daha çok söylemeye alıştığımız gibi katman). Bu çizgiler, elektronik geçiş olarak bilinen bir enerji değişimi sürecinde, bir elektron izin verilen bir enerji seviyesinden diğerine geçtiğinde ortaya çıkar.
Elektronik geçiş sırasında elektron daha düşük bir enerji seviyesinden daha yüksek bir enerji seviyesine geçer. Başlangıç seviyesine döndüğünde elektromanyetik radyasyon (ışık) yoluyla fazla enerji yayar ve Yayılan enerji değeri aşağıdaki denklemle tanımlanan bir değerle orantılı olan spektral çizginin kökeni Rydberg.
Johannes Rydberg, İsviçreli profesör Johann Balmer'in çalışmasına dayanarak spektral çizgilerin eğilimini tanımlamak için bir denklem oluşturan İsveçli bir spektroskopistti. Her katmanın özgül enerjisi uygun Schrödinger denkleminin çözülmesiyle tanımlanır.
Her elektronik katmanın izin verilen sayıda elektronu vardır. Şu anda, alfabetik sırayla K'dan Q'ya kadar olan harflerle veya n ≥ 1 olmak üzere n harfiyle tanımlanan yedi elektronik katman tanımlanmıştır. Dolayısıyla K katmanı, n = 1 olan katmandır ve bu böyle devam eder. Kabuk başına izin verilen elektron sayısı aşağıdaki tabloda gösterilmektedir.
Enerji seviyesi |
Katman |
Maksimum elektron sayısı |
1 |
k |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
N |
32 |
5 |
Ö |
32 |
6 |
P |
18 |
7 |
Q |
8 |
Hidrojenoid atomları için (H, He gibi yalnızca 1 elektronlu)+, Li2+), tüm atomik yörüngeler aynı enerjiye sahiptir (bunlara dejenere yörüngeler diyoruz); ancak iki veya daha fazla elektrona sahip atomlarda çok önemli bir etki ortaya çıkar: elektron-elektron itmesi. Bunun sonucunda her katmanın yörüngeleri farklı enerjilere sahip olmaya başlar ve bu nedenle katmanlar alt katmanlar (veya alt düzeyler) olarak tanımlanmaya başlar.
Mevcut atomlar için her katman dört adede kadar alt seviyeye ayrıştırılabilir., “s” harfleriyle temsil edilir (İngilizce'den, keskin), “p” (İngilizce'den, ana), “d” (İngilizce'den, yayılma) ve “f” (İngilizceden, esas).
Her alt düzey, hesaplamalar ve deneylerle tanımlanan maksimum sayıda elektronu destekler. “S” alt düzeyi 2 elektrona kadar destekler; 6 elektrona kadar “p” alt düzeyi; 10 elektrona kadar “d” alt düzeyi; ve “f” alt seviyesi, 14 elektrona kadar. K katmanı yalnızca tek bir yörüngeye izin veren tek katmandır ve bu nedenle yalnızca tek bir alt seviyeye sahiptir.
Enerji seviyesi |
Katman |
Alt seviyeler |
1 |
k |
1s |
2 |
L |
2s, 2p |
3 |
M |
3'lü, 3p, 3 boyutlu |
4 |
N |
4'ler, 4p, 4d, 4f |
5 |
Ö |
5'ler, 5p, 5d, 5f |
6 |
P |
6s, 6p, 6d |
7 |
Q |
7'ler, 7p |
Elektrosferin işlevi
Her atomun elektrosferi atomun çeşitli özelliklerini ve davranışlarını açıklamak için kullanılabilir.
Atom yarıçapı, iyon yarıçapı, iyonlaşma enerjisi ve elektron ilgisi gibi özellikler, elektrosferin elektronik konfigürasyonunun doğrudan bir sonucu olan değerlere sahiptir. değerlik kabuğu deniraslında bir atomun veya iyonun en dışta bulunan elektronik kabuğudur.
A Periyodik Tablodaki aynı gruptaki atomlar arasındaki benzerlik de elektronik konfigürasyonun bir sonucudur. değerlik kabuğundan. Kimyasal işlemlerde mümkün olduğunca Periyodik Tabloda aynı gruptan atomları seçeriz. ve bu atomlar katmanda aynı elektronik konfigürasyona sahip olduğundan bu sadece makuldür. değerlik.
Şuna: Kimyasal bağlarİyonik ve kovalent bileşikler (moleküller) oluşturmak için atomlar arasında meydana gelen etkileşimler, aynı zamanda atomların elektrosferleri arasındaki etkileşimler yoluyla da meydana gelir.
Sen de oku: Schrödinger'in atom modeli - atomu kuantum mekaniğini kullanarak tanımlamanın yolu
Elektrosfer ve atom yapısı arasındaki ilişki
Belirtildiği gibi, elektrosfer atomun elektronların bulunabileceği bölgesini kapsar. Elektronlar, daha spesifik olarak, enerjileri kuantum hesaplamalarıyla tanımlanan atomik yörüngelerde bulunur.
Elektrosfer atom yapısının en büyük bölgesidirÇünkü atomun çekirdeği çok küçüktür. Atomu bir futbol stadyumu gibi düşünürsek, çekirdek sahanın ortasındaki bir topa karşılık gelirken, stadyumun geri kalanı elektrosfer olacaktır.
Her şeye rağmen, kütle açısından elektrosferin katkısı çok azdır. Elektronların kütlesi, proton ve nötronların kütlesinden yaklaşık 1836 kat daha küçük olduğundan, atomun kütlesinin neredeyse tamamının çekirdekte yoğunlaştığını söyleyebiliriz.
Elektrosferde çözülmüş egzersizler
Soru 1
(Facisb 2023) Bohr'un hidrojen atomu modelinde elektron yalnızca belirli yörüngeleri işgal edebilir. Bu yörüngelerden bazıları şekilde gösterilmektedir; burada n, elektronun her yörüngede sahip olduğu enerji seviyelerini ifade eder.
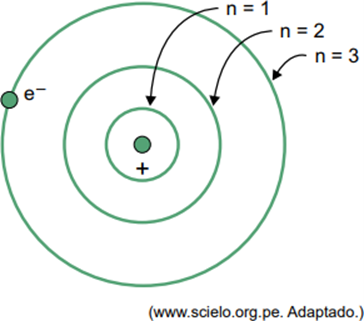
Bir hidrojen atomunda elektronun n = 5 olan yörüngede olduğunu düşünün.
Bohr modeline göre bu elektron ancak elektromanyetik radyasyon şeklinde enerji yayacaktır.
(A) n'nin 6'ya eşit olduğu yörüngeye geçiş yapın.
(B) n = 5 olan yörüngede kalır.
(C) n'nin 5'ten büyük olduğu herhangi bir yörüngeye geçiş.
(D) n'nin 5'ten küçük olduğu herhangi bir yörüngeye geçiş.
(E) atomdan dışarı atılır ve onu iyonlaştırır.
Cevap: D harfi
Bir elektron dış kabuktayken, daha düşük enerjili iç kabuğa döndüğünde fazla enerjiyi elektromanyetik radyasyon (ışık) şeklinde serbest bırakır. Dolayısıyla ışığın oluşması ancak n = 5'te bulunan elektronun bir iç kabuğa geçiş yapmasıyla gerçekleşecektir.
soru 2
(Uerj 2019) Son zamanlarda bilim insanları moleküler hidrojeni yüksek basınç altında sıkıştırarak metalik hidrojen üretmeyi başardılar. Bu elementin metalik özellikleri periyodik sınıflandırma tablosunun 1. grubundaki diğer elementlerle aynıdır.
Bu benzerlik, bu elementlerin en enerjik alt seviyesiyle ilgilidir ve bu da aşağıdakilere karşılık gelir:
(A) ns1
(B) n.p.2
(C) hayır3
(D)nf4
Cevap: A harfi
Hidrojen atomunun yalnızca birinci düzeyde, alt düzey "s"de (1s) yer alan tek bir elektronu vardır.1). Periyodik Tablonun 1. grubunda bulunmasının bir nedeni, bu gruptaki diğer tüm kimyasal elementlerin değerlik kabuğu aynı türden (ns) olan atomlara sahip olmasıdır.1). Dolayısıyla benzer değerlik katmanı nedeniyle hidrojenin bu metalik formda üretilmesi mümkün oldu.
Kaynaklar:
DO CANTO, E. L.; LEITE, L. L. W.; CANTO, L. W. Kimya – günlük yaşamda. 1. ed. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Kimyanın İlkeleri: Hayatı ve çevreyi sorgulamak. 7. ed. Porto Alegre: Kitapçı, 2018.
ATKINS, P.; DE PAULA, J.; KEELER, J. Atkins'in Fiziksel Kimyası. 11 baskı. Oxford: Oxford University Press, 2018.
