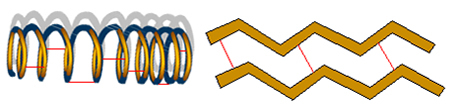
Yapısal formül, iki atom arasında paylaşılan her elektron çiftinin bir tire ile sembolize edildiği, elementler arasındaki bağları temsil etmenin bir yoludur:
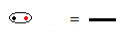
Kısa çizgi ile sembolize edilen ortak elektron çifti
Bu, tekli, ikili veya üçlü olsun, yapısal formülde her tür kovalent bağın göründüğü anlamına gelir:
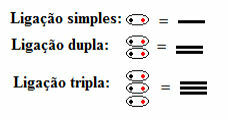
Yapısal formüllerde kısa çizgilerle sembolize edilen tekli, ikili ve üçlü bağlar
Birkaç bağ içeren küçük moleküllü yapısal formüllerin bazı örneklerine bakın ve paylaşılan elektron çiftlerinin nasıl temsil edildiğine dikkat edin.
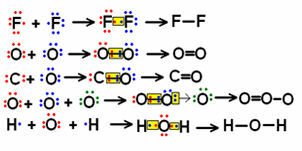
Bazı moleküller için yapısal formül örnekleri
Elektronik çiftlerin “nokta” ile sembolize edildiği, sol üstte gösterilen formüllere denir. elektronik formüller veya Lewis formülleri. Bu moleküllerin tümü inorganik maddelerdir, ancak yapısal formüller genellikle organik bileşikler söz konusu olduğunda daha çok kullanılır. mineral kökenli olmayan (karbon monoksit (CO) durumunda olduğu gibi) karbon elementi tarafından oluşturulanlardır. inorganik).
Karbon dört değerlikli olduğundan (dört kovalent bağ yapar), büyük sonsuz sayıda zincir oluşturarak farklı atomlara ve diğer karbonlara bağlanma yeteneği karbonik. Bu yüzden yapısal formül önemlidir çünkü
zincirdeki atomların dizilişini gösterir.Anlamak için aşağıdakileri göz önünde bulundurun: a Moleküler formül sadece maddenin bir molekülündeki her bir elementin sayısını gösterir. Örneğin, C moleküler formülümüz olduğunu varsayalım.3H6, o zaman üç karbon atomu ve altı hidrojen atomu olduğunu biliyoruz, ancak bunlar nasıl bağlanır? Yapısal formül bize bunu söyleyecektir ve aslında hangi bileşik olduğunu bulabiliriz. Aşağıda, bu moleküler formülün iki farklı yapısal formüle ve dolayısıyla iki farklı maddeye yol açabileceğine dikkat edin:

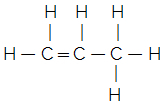
Siklopropan Propen
Bunlar çağrılabilirdüz yapısal formüllertüm bağlantıların ve tüm elemanların kağıt, karatahta, bilgisayar ekranı vb.
Bununla birlikte, birçok karbon zinciri çok büyük ve oldukça karmaşıktır, bu nedenle yapısal formülü her seferinde düz yazmak zorunda kalmak zor olacaktır.
Böylece, molekül yapısının daha basitleştirilmiş başka temsil biçimleri yaratıldı. Birincisi basitleştirilmiş veya yoğunlaştırılmış yapısal formül, her bir karbona bağlı hidrojen atomlarının sayısının sembolü (H) konularak kısaltıldığı sadece bir kez ve sağ alt köşeye, kaç hidrojen olduğunu gösteren bir sayı olan bir indeks ekleyerek var.
Örneğin, ortak eterin düz yapısal formülünü düşünün:
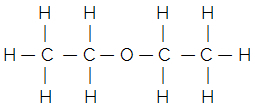
Basitleştirilmiş veya yoğunlaştırılmış yapısal formülü şu şekilde verilir:
H3C - CH2 - O - CH2 - CH3
Çok daha basit, değil mi?!
Ancak karbonun her zaman dört bağ oluşturduğunu ve hidrojenin yalnızca bir bağ oluşturduğunu bilerek, çizgilerin formülü olan daha da basit bir formül ortaya çıktı. Dilerseniz nasıl yazılacağını metinde daha detaylı görebilirsiniz. Organik Bileşiklerin Moleküler Formülleri. Ancak temel olarak, bu formülde C, CH, CH grupları atlanmıştır.2 ve CH3, zikzak bağlantılı kısa çizgilerle temsil edilir. Aşağıda, yukarıda bahsedilen eterin yapısal formülüne sahibiz:
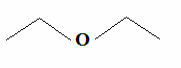
Ortak Eter İz Formülü
Bununla birlikte, madde formüllerinin uzayda tam olarak düz olmadığı oldukça doğrudur. Bu nedenle, bazı durumlarda daha uzamsal bir fikir vermek için yazarlar. perspektif içinde formüller, bağlantıların gösterebileceği yerler atomun düzlemde (normal vuruş), düzlemin arkasında (noktalı kama) veya düzlemin önünde (tam kama) olup olmadığı:

Perspektifteki formüllerdeki temsiller
Örneğin, aşağıdaki kortizol formülüne bakın. Bir hidrojen, bir hidroksil grubu (OH) ve iki metil grubu (CH3 - atlanmıştır) düzlemin önündedir, iki hidrojen ve bir hidroksil grubu düzlemin arkasındadır ve geri kalanı düzlemdedir.

Kortizol perspektifinde yapısal formül
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-formula-estrutural.htm