Hibridizasyon Teorisi, bu teorinin tamamlayıcısı olarak ortaya çıkmıştır. oktet teorisi, bor tarafından oluşturulan moleküller de dahil olmak üzere daha fazla sayıda molekülün yapısını açıklamayı başarıyor (B).
Bu eleman, aşağıdaki elektronik konfigürasyona sahip beş temel durum elektronuna sahiptir:
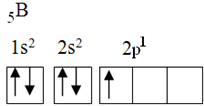
Oktet teorisine göre, bor sadece bir tane tamamlanmamış atomik yörüngeye sahip olduğu için sadece bir kovalent bağ yapabilirdi. Ancak deneysel olarak bu elementin birden fazla bağ yaptığı bileşikler oluşturduğu not edilir.
Bir örnek bor triflorürdür (BF3). Aşağıda gösterildiği gibi bor, flor ile üç kovalent bağ yapar ve üç çift elektronlar ve son kabuğunda (değerlik katmanı) altı elektron bulunan, yani kuralın bir istisnası sekizli.
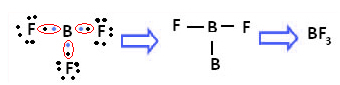
Bu, bor ile meydana gelen hibridizasyon fenomeni ile açıklanmaktadır. 2s alt seviyesinden bir elektronun enerjiyi emdiği ve alt seviye 2p'nin boş bir yörüngesine atladığı uyarılmış duruma geçtiği ortaya çıktı. Bu şekilde, şimdi üç kovalent bağ yapabilen üç eksik orbital oluşur:
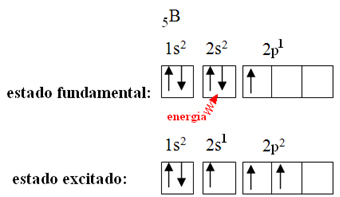
Ancak bor triflorürde oluşan bağların hepsi aynıdır, ancak yukarıya bakarsak iki bağ vardır. farklıdır, çünkü bunlardan biri bir s orbitali vasıtasıyla ve diğer ikisi de tipte bir orbital vasıtasıyla yapılacaktır. p yazın. Hibridizasyonun gerçekleştiği yer burasıdır, yani tamamlanmamış orbitaller birleşerek üç taneye yol açar. hibrit yörüngeler veya melezleştirilmiş, orijinallerinden aynı ve farklı olanlar:
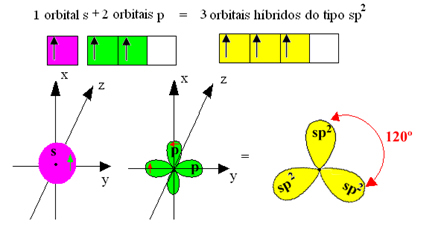
Bu hibrit orbitaller bir s orbitali ve iki p orbitalinden oluştuğu için bu hibritleşmeye denir. sp² hibridizasyonu.
Bora bağlanan florin dokuz elektronu vardır. Elektronik dağılımı ve yörüngeleri aşağıda gösterilmiştir:
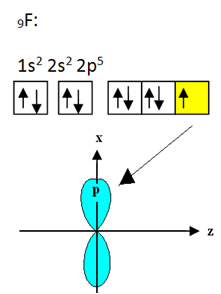
Her flor atomunun yalnızca bir kovalent bağ yapabileceğine ve bu bağı oluşturan yörüngenin p tipinde olduğuna dikkat edin. Bu nedenle, BF'yi oluşturan bağlantıları yaparken orbitallerin nasıl oluştuğunu aşağıda gözlemleyin.3 ve bağlantıların nasıl aynı olduğunu görün, örneğin σp-sp2:
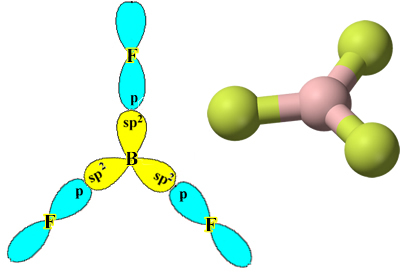
Bu aynı zamanda diğer öğelerle de olur, örneğin, " metnine bakın.Berilyum Hibridizasyonu”.
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm
