bu pil oksidasyon-redüksiyon reaksiyonunun gerçekleştiği bir sistemdir. Bu cihazda, kendiliğinden gerçekleşen reaksiyonda üretilen kimyasal enerji, elektrik enerjisine dönüştürülür.
Bir hücrede oksidasyon ve indirgeme reaksiyonları aynı anda meydana gelir. Bir tür oksidasyona uğradığında, elektronları diğer türe bağışlar ve elektronları aldıktan sonra indirgenir.
Bu nedenle, oksidasyona uğrayan indirgeyici ajan, indirgeme geçiren ise oksitleyici maddedir.
bu oksidasyon bir tür elektron kaybedip katyon haline geldiğinde oluşur: A → A+ + ve-.
bu kesinti bir tür elektron kazandığında ve elektriksel olarak nötr hale geldiğinde oluşur: B+ + ve- → B.
Kimyasal denklemlerde, bu elektron transferi oksidasyon numarasındaki (nox) değişiklik ile gösterilir.
Hücrelerin içinde indirgeme reaksiyonları meydana gelir ve elektronların negatiften pozitif kutba göç etmesiyle elektrik akımı ortaya çıkar.

Bir yığın nasıl çalışır?
Bir Redoks reaksiyonu genel olarak şu denklemle temsil edilebilir:
A + B+ → Bir+ + B
Neresi,
A: Oksitlenen, elektron kaybeden, değerini artıran ve indirgeyici madde olan madde.
B: İndirgenen, elektron alan, oksidasyonu azaltan ve oksitleyici madde olan madde.
Aşağıdaki resimde bu işlemin nasıl temsil edilebileceğine bakın.
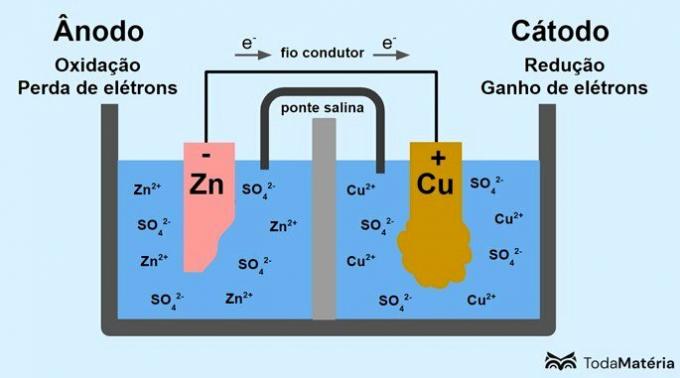
İki yarı hücreye bölünmüş ve iletken bir tel ile harici olarak bağlanan iki metalik elektrottan oluşan sistem, 1836'da John Frederic Daniell (1790-1845) tarafından geliştirilmiştir.
Pil, iletken bir tel ile birbirine bağlanan iki elektrot ve iyonların bulunduğu bir elektrolitten oluşur. Elektrot, elektron alışverişini sağlayan katı iletken yüzeydir.
anot: oksidasyonun meydana geldiği elektrot. Aynı zamanda pilin negatif kutbudur.
Katot: redüksiyonun meydana geldiği elektrot. Aynı zamanda pilin pozitif kutbudur.
Yukarıdaki resimde metalik çinko anottur ve oksidasyon. Metalik bakır katottur ve indirgenir. Elektronların (e-) göçü, iletken tel aracılığıyla anottan katoda doğru gerçekleşir.
Görüntü sisteminde meydana gelen reaksiyonlar şunlardır:
- anot (oksidasyon): Zn(s) → Zn2(burada) + 2e-
- Katot (azaltma): Cu2+(burada) + 2e- → eşek(s)
- genel denklem: Zn(s) + göt2+(burada) → eşek(s) + Zn2+(burada)
Çinko, elektron kaybetme eğilimi daha yüksek olan bir metaldir ve bu nedenle çözeltide katyonlar oluşur. Çinko elektrot, Zn katyonları oluştururken çinko çözeltiye salındığı için aşınmaya ve kütle kaybetmeye başlar.2+.
Anottan gelen elektronlar katoda ulaşır ve metal katyonları onları aldıktan sonra metalik bakıra dönüştürülür, bu da elektrot üzerinde birikir ve kütlesini arttırır.
Tuz köprüsü, elektriksel olarak nötr tutmak için sistemdeki iyonların dolaşımından sorumlu iyonik bir akımdır.
Ayrıca hakkında okuyun oksidasyon numarası (nox).
pil türleri
Bir hücrede, kimyasal türlerin elektron alma veya verme eğilimi, indirgeme potansiyeli tarafından belirlenir.
En yüksek indirgeme potansiyeline sahip bileşen, indirgenmeye, yani elektron kazanmaya eğilimlidir. En düşük indirgeme potansiyeline ve dolayısıyla en yüksek oksidasyon potansiyeline sahip türler elektron aktarma eğilimindedir.
Örneğin, redoks reaksiyonunda Zn0(s) + göt2+(burada) → eşek0(s) + Zn2+(burada)
Çinko oksitlenir ve elektron verir çünkü indirgeme potansiyeli E'ye sahiptir.0 = -0.76V, bakır E'nin indirgeme potansiyelinden daha az0 = +0.34V ve bu nedenle elektron alır ve indirgenir.
Diğer yığın örnekleri için aşağıya bakın.
Çinko ve hidrojen yığını
Oksidasyon yarı reaksiyonu: Zn(s) → Zn2+ + 2e- (VE0 = -0.76V)
Azaltma yarı reaksiyonu: 2H+(burada) + 2e- → H2(g) (VE0 =0,00V)
Küresel denklem: Zn(s) + 2H+(burada) → Zn2+(burada) + H2(g)
Yığın temsili:
Bakır ve hidrojen hücresi
Oksidasyon yarı reaksiyonu: H2(g) → 2H+(burada) + 2e- (VE0 = 0,00V)
İndirgeme yarı reaksiyonu: Cu2+(burada) + 2e- → eşek(s) (VE0 = +0.34V)
Küresel Denklem: Cu2+(burada) + H2(g) → 2H+(burada) + göt(s)
Yığın temsili:
İçeriği ile konu hakkında daha fazla bilgi edinin:
- elektrokimya
- Elektroliz
Bibliyografik referanslar
FONSECA, M. R. M. Kimya, 2. 1. ed. Sao Paulo: Attika, 2013.
SANTOS, W.L.P; MOL, G.S. Vatandaş kimyası, 3. 2. ed. Sao Paulo: Editör AJS, 2013.
USBERCO, J. Kimyayı bağlayın, 2: kimya. - 2. ed. Sao Paulo: Saraiva, 2014.