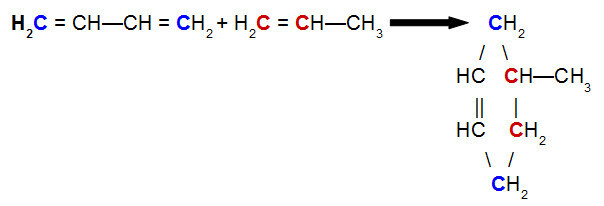NS damıtma homojen karışımları, yani bileşenler tek fazdayken ayırma yöntemidir.
İki tür damıtma vardır. Basit damıtma, katı-sıvı ayrımında ve birbirleriyle karışabilen sıvıların bir karışımında fraksiyonel damıtmada kullanılır.
Bir karışımın belirli bir bileşenini izole edebilmek için bir değişkeni değiştirmek gerekir. Damıtma durumunda, ilgilenilen bileşenin fiziksel durumunu değiştirecek şekilde sıcaklık değiştirilerek ayırma meydana gelir.
Bu işlemde kullanılan maddelerin özelliği, kaynama noktasıyani sıvıdan gaza geçişin gerçekleştiği sıcaklık.
damıtma işlemi
Damıtma işlemi, ilgilenilen bileşenin kaynama noktasına ulaşılana kadar bir karışıma ısı verilmesinden ve kendisini diğerlerinden ayırarak gaz haline geçmesinden oluşur.
Bundan sonra gaz, erime noktasına ulaşana kadar maddeden ısının alınacağı bir soğutma kolonundan geçer ve böylece sıvı hale geri döner. Bu malzeme başka bir kaba yönlendirilir.
basit damıtma
Homojen bir karışımı ayırmak için sıvı içinde çözülmüş katı basit damıtma kullanılır.
Aşağıdaki resimde ayırma işlemi için temel ekipmanları görebiliriz.

Onlar:
- Karışımı içeren damıtma şişesi (1);
- Karışıma ısı sağlayan ısıtıcı battaniye (2);
- Sıcaklık değişimini izlemek için termometre (3);
- Kondenser (4), buharlaşan bileşeni soğutmak ve
- Beher (5), ayrılan bileşeni sıvı halde toplamak için.
Bu işlem, örneğin sofra tuzu olarak bilinen sodyum klorürü (NaCl) ve suyu ayırmak için kullanılabilir. Tuzun kaynama noktası 1465 °C'dir ve suda çözünerek homojen bir karışım oluşturur.
Su 100 ºC kaynama noktasına sahip olduğu için kolaylıkla gaz hale geçer ve karışımdan ayrılır, tuz ise kapta kristalleşir ve katı halde kalır.
Su buharı damıtma şişesinin tepesinden çıkar ve bir yoğunlaştırıcıdan geçer. Bu ekipmanın duvarlarında soğuk veya soğuk su dolaşır. Akışkanlar arasındaki ısı değişimi, karışımın ayrılan bileşeninin ısı kaybetmesine ve başka bir kapta toplanmak üzere sıvı hale dönmesine neden olur. Bu sıvıya distilat denir.
kademeli damıtma
Homojen bir karışımı ayırmak için Birbiriyle karışabilen sıvılar ve kaynama sıcaklıkları arasındaki büyük farkla, fraksiyonel damıtma kullanılır.
Bu yöntem fraksiyonlanmıştır çünkü bileşenler karışımdan artan kaynama noktası sırasıyani, en düşükten başlayarak, fazı değiştirmek için en yüksek sıcaklığı gerektirene kadar.
Aşağıdaki görselde yöntemi gerçekleştirmek için kullanılan ekipmanlar bulunmaktadır.
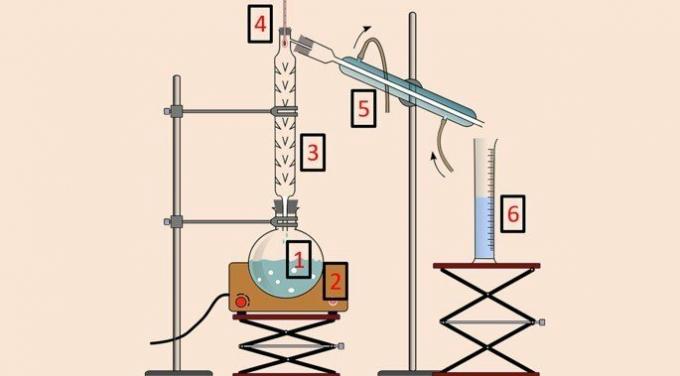
Basit distilasyonda olduğu gibi distilasyon şişesi (1), ısıtma battaniyesi (2), termometre (4), kondenser (5) ve beher (6) kullanılmaktadır. Ancak damıtma veya fraksiyonasyon kolonu (3) sıcaklığa göre ayırmaya izin veren donanımdır.
Damıtma kolonu, karışımın tüm bileşenlerinin aynı anda buharlaşmasını önlemek için içinde bir dizi engele sahiptir.
Bu işlem, hidrokarbonların bir karışımı olan petrol fraksiyonlarını ayırmak için yaygın olarak kullanılmaktadır. Petrol bileşenlerinden bazıları ve bunların kaynama noktaları (PE) şunlardır: bütan (PE 20 ºC), benzin (PE 150 ºC) ve kerosen (PE 300 ºC).
Fraksiyonel damıtma yoluyla, bütan, en düşük kaynama noktasına sahip olduğu için ayrılan ilk bileşendir, ardından ara kaynama noktasına sahip benzin ve son olarak kerosendir.
Damıtma Uygulamaları
Damıtma, birçok karışım bu işleme tabi tutulduğu için endüstrilerde yaygın olarak kullanılmaktadır. Yöntem kullanılarak viski, brendi ve votka gibi alkollü içkiler yapılır.
Petrokimya endüstrisi, petrolü rafine etmek için fraksiyonel damıtma kullanır. Damıtma kuleleri, bu fosil yakıtın fraksiyonlarını ayırmak için yapılmış büyük yapılardır.

Damıtma egzersizleri
soru 1
Damıtma, özellik tabanlı bir ayırma yöntemidir.
Kimya
b) Fizik
c) Biyolojik
d) Konunun geneli
Alternatif: b) Fizik.
Kaynama noktası, belirli bir maddenin doğasında olduğu için maddenin belirli bir fiziksel özelliğidir. Bir maddenin sıvı halden gaz hale geçtiği, yani buharlaştığı sıcaklıktır.
soru 2
Bunlar damıtma ile ayrılan karışımların örnekleridir, HARİÇ
a) su + aseton
b) tuzlu su
c) su + yağ
d) deniz suyu
Doğru alternatif: c) su + yağ.
Su ve yağ karışmayan maddelerdir. Bu durumda, karışımın bileşenlerini ayırmak için dekantasyon yöntemi kullanılır. Bu yöntem yoğunluk farkına dayanmaktadır.
Tuzlu su (su + tuz) ve içinde çözünmüş tuzları da bulunan deniz suyu basit damıtma ile ayrılır. Su ve aseton için fraksiyonel damıtma kullanılır.
Soru 3
(UFRGS) A, B ve C olmak üzere üç farklı sıvıdan oluşan iki fazlı heterojen bir sistem. Şu bilinmektedir:
A ve B birbiriyle karışabilir;
C, A ve B ile karışmaz;
A, B'den daha uçucudur.
Bu bilgilere dayanarak, üç sıvıyı ayırmak için en uygun yöntemler şunlardır:
a) santrifüjleme ve boşaltma.
b) dekantasyon ve fraksiyonel eritme.
c) süzme ve santrifüjleme.
d) süzme ve fraksiyonel damıtma.
e) dekantasyon ve fraksiyonel damıtma.
Doğru alternatif: e) dekantasyon ve fraksiyonel damıtma.
Sorunun heterojen sisteminin iki aşaması vardır:
Aşama 1: Birbiriyle karışabilen sıvı A ve B
Faz 2: Diğer bileşenlerle karışmayan sıvı C
Bu nedenle yoğunluk farkından dolayı 1. faz, 2. fazdan dekantasyon yöntemiyle ayrılır. Kaynama sıcaklığındaki farklılık nedeniyle A, B'den daha uçucu olduğundan, yani kolayca gaz haline geçme eğiliminde olduğundan, fraksiyonel damıtma kullanılır.
İçerikle daha fazla bilgi edinin:
- Basit ve fraksiyonel damıtma
- Karışımların ayrılması
- Karışımların ayrılması ile ilgili alıştırmalar