NS entalpi olan bir termodinamik fonksiyondur izobarik süreçlerde yer alan ısıyı hesaplaryani sabit basınç altında tutulanlardır. Gelişimi, kalori teorisinin çöküşünden kısa bir süre sonra gerçekleşti. termodinamik 1840 ve 1850 yılları arasında.
için entalpi, neumika, mutlak ve izole bir değer olarak çalışıldığında pek bir anlamı yoktur, ancak kimyasal bir işlemde değerinin değişmesi. Bir sürecin entalpi değişimini hesaplamanın birkaç yolu vardır, başlıcaları oluşum enerjileri, bağlanma ve ayrıca oradahey hess'ten.
Siz de okuyun: Gibbs Serbest Enerjisi Nedir?
Entalpi Özeti
Entalpi, sabit basınçta meydana gelen süreçlerde yer alan ısıyı hesaplamak için termodinamik bir araçtır.
Amerikalı fizikçi Josiah W. Gibbs, kalori teorisinin düşüşü bağlamında.
Kimyada her zaman ΔH olarak gösterilen entalpi değişimini kullanırız.
Isıyı emen kimyasal reaksiyonlara endotermik denir ve ΔH > 0'a sahiptir.
Isı açığa çıkaran kimyasal reaksiyonlara ekzotermik denir ve ΔH < 0'a sahiptir.
Entalpi hakkında video dersi
entalpi nedir?
Her zaman H ile temsil edilen entalpi başlangıçta Amerikalı fizikçi Josiah Willard Gibbs tarafından tanımlanan, sabit basınçta ısı fonksiyonu olarak adlandırdı, çünkü kendi sözleriyle:
“[…] fonksiyondaki azalma, basıncın değişmediği her durumda, sistem tarafından verilen ısıyı temsil eder.”
O halde Gibbs'in çalışmasından entalpiyi termodinamik bir fonksiyon olarak anlayabiliriz. varyasyon, sistemde değiştirilen ısı miktarına sayısal olarak eşittir, baskı yapmak devamlı. Bu, izobarik süreçlerde (çoğu kimyasal süreç gibi), bilmenin entalpi fonksiyonunun değişimini hesaplayın, daha sonra sistem ile sistem arasında değiştirilen ısının değeri bilinebilir. komşu.

Isı nedenleri ile böyle bir korelasyon birçok öğrenci yanlışlıkla entalpinin eş anlamlı olduğunu düşünür. sıcaklık veya enerji içeriği, ısı içeriği, salınan ısı ve emilen ısı ve benzerleri gibi bir şey.
Entalpi, ısıyı daha sıcak cisimlerden daha soğuk cisimlere aktarılan ölçülemez bir maddi madde olarak ele alan kalori teorisinin çöküşü bağlamında ortaya çıktı. Bu nedenle, ısıyı hesaplamak için yeni bir araca ihtiyaç vardı. O halde çözüm, entalpi gibi termodinamik denklemleri önceden tanımlamış olan miktarları kullanmaktı.
Siz de okuyun: Çözeltinin entalpi değişimi nasıl hesaplanır?
entalpi değişimi
Entalpi, kimyasal bir işlemde değiş tokuş edilen ısıyı hesaplamak için kullanılan bir araç olduğundan, onu mutlak, izole bir sayı olarak kullanmak anlamsızdır, ancak varyasyonunu göz önünde bulundurarak, yani pratikte, termodinamik bize garanti ettiği için, kimyasal süreç sırasında entalpinin sayısal olarak ne kadar değiştiğini değerlendirmeliyiz. varyasyon işlemde salınan veya emilen ısıya sayısal olarak eşit.
Kesin olarak konuşursak, entalpi değişimini şu şekilde tanımlayabiliriz:
ΔH = Hson - Hilk
Kimyasal işlemlerde olduğu gibi, son adım ürünler olarak kabul edilebilir ve ilk adım reaktifler olarak kabul edilebilir. Entalpi varyasyonunun tanımını şu şekilde görmek de yaygındır:
ΔH = HÜrün:% s - Hreaktifler
Pratik ve yorumlayıcı bir bakış açısından, entalpi değişimi pozitif ise (ΔH> 0), kimyasal reaksiyonun olduğunu söylüyoruz endotermikyani süreç boyunca ısı emilimi vardır. Çoktan entalpi değişimi negatif ise (ΔH< 0), kimyasal reaksiyonun olduğunu söylüyoruz ekzotermikyani süreç boyunca ısı açığa çıkar.
Aşağıdaki örneklerde gösterildiği gibi, birçok durumda entalpi değişimi grafiklerde gözlenir.
Örnek 1:
Endotermik Reaksiyon Tablosu
Endotermik reaksiyonlar için entalpi grafiklerinde, ürünlerin entalpi miktarının reaktanlardan daha fazla olduğu görülebilir, bu da reaksiyon boyunca değişimin pozitif olduğunu gösterir. Böylece ΔH > 0 ise kimyasal işlemin ısı absorpsiyonu ile gerçekleştiğini söyleyebiliriz.
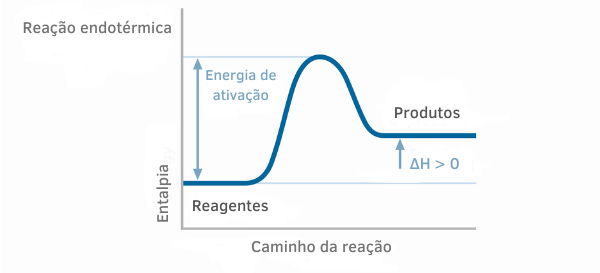
Örnek 2:
Ekzotermik Reaksiyon Tablosu:
Ekzotermik reaksiyonlar için entalpi grafiklerinde, ürünlerin entalpi miktarının reaktanlarınkinden daha küçük olduğu görülebilir, bu da reaksiyon boyunca değişimin negatif olduğunu gösterir. Böylece, ΔH < 0 olduğu için, kimyasal işlemin ısı salınımı ile gerçekleştiğini söyleyebiliriz.
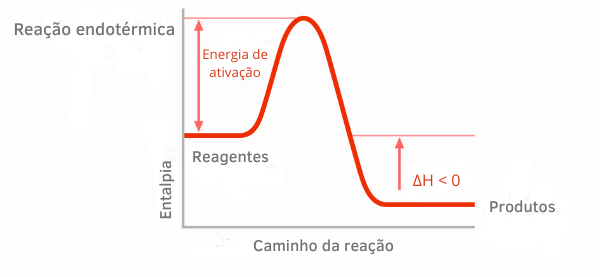
Metinde bu kimyasal reaksiyon sınıflandırmaları hakkında daha fazla bilgi edinin: İÇİNendotermik ve ekzotermik süreçler.
entalpi türleri
oluşum entalpisi
NS oluşum entalpisi é hesaplanmış göre oluşum kimyasal reaksiyonlaroda sıcaklığında ve 1 atmosfer basınçta en kararlı basit maddelerinden bir mol bileşik maddenin oluştuğu reaksiyonlardır.
H2(g) + ½ O2 (g) → H2O (l) H°F = -286 kJ/mol
Oluşum entalpisinin en büyük avantajı, oda sıcaklığında ve 1 atmosfer basınçta daha kararlı olan basit maddelerin sıfıra kabul edilen bir entalpiye sahip olmasıdır. Bu aslında sıfır oldukları anlamına gelmez, ancak basitleştirme ve daha iyi sınıflandırma için bu şekilde ele alınırlar.
Olmak H = HÜrün:% s - Hreaktifler, düşünürsek, o zaman, Hreaktifler = 0ΔH'nin gözlemlenen değerinin yalnızca bu durumlarda her zaman bileşik maddenin bir molünü oluşturan ürünlerle ilgili olduğunu söyleyebiliriz. Bu nedenle, bu değeri ΔH° ile temsil edilen su oluşumunun standart entalpi değişimi olarak tablolaştırıyoruz.F.
Bu metodoloji ile birçok maddenin kendi varyasyonları vardı. standart entalpi formasyon tabloları, aşağıda görebileceğimiz gibi.
Madde |
Oluşum entalpisi (ΔH°F) kJ/mol cinsinden |
CO2 (G) |
-393,4 |
CaO(lar) |
-634,9 |
HI(g) |
+25,9 |
HAYIR (g) |
+90,1 |
bağlanma entalpisi
Bağlanma entalpisi, belirli bir molün kırılması veya oluşumunda yer alan enerji miktarını göstermeye hizmet eder. Kimyasal bağ.
Anlaşılan budur ki, kimyasal bir bağı kırmak için ısıyı emmek gerekir, böylece bağ atomları artar içsel enerji ve sonuç olarak, kinetik enerjinizi artırın. daha büyük kinetik enerjiatomlar daha yoğun titreşerek bağların kopmasına neden olur. Bu nedenle, her bağ kopması endotermik bir süreçtir.
Aksi takdirde, kimyasal bir bağ oluşturmak için atomlar hareket özgürlüğünü kaybederler ve hareket derecelerini azaltarak kinetik enerjilerini düşürmeleri gerekir. Yedek enerji daha sonra ısı şeklinde serbest bırakılır. Böylece, tüm bağ oluşumu ekzotermik bir süreçtir.
Aşağıdaki tablo, her bir kimyasal bağla ilişkili enerjilerin değerlerini göstermektedir.
Bağlantı |
Bağlanma enerjisi (kJ/mol) |
C-H |
412,9 |
CC |
347,8 |
O=O |
497,8 |
F-F |
154,6 |
NUMARA |
943,8 |
Modülde olduğu için değerlerde işaret olmadığına dikkat edin. Bunun nedeni, bağlantının kopmuş veya oluşmuş olmasına bağlı olarak sinyalin sizin tarafınızdan atanması gerektiğidir.
yanma entalpisi
NS yanma entalpisi belirtmeye hizmet eder bir mol maddenin yanması sonucu açığa çıkan ısı miktarı. Her yanma ısı açığa çıkardığından, her yanma reaksiyonunun ekzotermik olduğuna dikkat edilmelidir.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2H2ΔH°C = -889.5 kJ/mol
Aşağıdaki tablo bazı kimyasal maddeler için yanma entalpisi değerlerini göstermektedir.
Madde |
Yanma entalpisi (ΔH°C) kJ/mol cinsinden |
Etanol - C2H5OH (1) |
-1368 |
Benzen - C6H6 (1) |
-3268 |
Oktan - C8H18 (1) |
-5471 |
Glikoz - C6H12Ö6 (s) |
-2808 |
Fiziksel hal değişiminin entalpisi
Fiziksel durumdaki her değişiklik ısı alışverişini içerir. bu yüzden fiziksel hal değişimi entalpisi belirtmeye hizmet eder fiziksel hal değişim süreçlerinde yer alan ısı miktarı.
Örneğin, su buharlaştırmamız var:
H2O (1) → H2O (g) ΔH = +44 kJ/mol
Suyun erimesinde elimizde:
H2O(lar) → H2O (l) ΔH = +7.3 kJ/mol
Entalpi değerleri ters işlemler için simetriktirBu, örneğin, suyun sıvılaşmasındaki entalpi değişiminin -44 kJ/mol olduğu, katılaşmasında ise -7.3 kJ/mol'e eşit olduğu anlamına gelir.
Siz de okuyun: entropi nedir?
Entalpi ile ilgili çözülmüş alıştırmalar
Soru 1 - (UERJ 2018) Yakıt olarak kullanılan bir hidrokarbonun kirletici kapasitesi, açığa çıkan enerji ile CO miktarı arasındaki oran ile belirlenir.2 tam yanması sonucu oluşur. Oran ne kadar yüksek olursa, kirletici kapasite o kadar düşük olur. Aşağıdaki tablo, dört hidrokarbonun standart yanma entalpisini göstermektedir.

Tablodan, en düşük kirletici kapasiteye sahip hidrokarbon:
Oktan
heksan
Benzen
pentan
Çözünürlük
alternatif D
Soru, kirletici kapasitenin açığa çıkan enerji ile CO miktarı arasındaki oran (bölüm) olarak tanımlandığını gösterir.2 tam yanması sonucu oluşur. daha büyük sebep, kirletme kapasitesi ne kadar düşükse, yani CO molü başına daha fazla enerji açığa çıkar.2 oluşturuldu.
Tam yanma reaksiyonları hidrokarbonlar anılanlar:
Oktan: C8H18 +25/2 O2 → 8 CO2 + 9 saat2Sebep: 5440/8 = 680
heksan: C6H14 +19/2 O2 → 6 CO2 + 7 saat2Sebep: 4140/6 = 690
Benzen: C6H6 + 15/2 O2 → 6 CO2 + 3 Saat2Sebep: 3270/6 = 545
pentan: C5H12 + 8 O2 → 5 CO2 + 6 Saat2Sebep: 3510/5 = 702
Böylece, en düşük kirletici kapasiteye sahip hidrokarbonun pentan olduğu sonucuna varabiliriz.
Soru 2 - (Enem 2015) Yenilenebilir bir enerji kaynağı oldukları için orman artıklarının kullanımı her geçen gün daha cazip hale geliyor. Şekil, odun atıklarından çıkarılan bir biyo-yağın yakılmasını temsil etmektedir, burada ΔH1 Karbondioksit ve sıvı su ile sonuçlanan bu biyo-yağın 1 gramının yanmasından kaynaklanan entalpi değişimi ve ΔH2 Gaz halindeki 1 g suyun sıvı hale dönüştürülmesinde yer alan entalpi değişimi.

Bu biyo-yağdan 5 g yakmak için kJ cinsinden entalpi değişimi CO2 ile sonuçlanır.2 (gazlı) ve H2(gazlı):
A) -106
B) -94
C) -82
D) -21.2
E) -16,4
Çözünürlük
alternatif C
Gösterilen grafikten, ΔH'ye sahibiz1 CO üreten biyo-yağ yakmanın entalpi değişimi olarak2 (g) ve H2O (1) ve ΔH2 CO olduğundan, su sıvılaşmasının entalpi değişimi olarak2 gaz halinde kalır ve yalnızca fiziksel hali Suçlu değişir (gazdan sıvıya).
Alıştırma, CO2 ile sonuçlanan 5 g biyo-yağ yakmanın entalpi değişimini sorar.2 (gazlı) ve H2O (gaz halinde). Diyagramdan, bu entalpi değişimi ΔH = ΔH olarak tanımlanabilir.1 - H2. Böylece ΔH değeri -16,4 kJ/g'ye eşit olacaktır. Bu varyasyon, ünitede gördüğümüz gibi, HER gram biyo-yağ içindir. 5 gram için yapmalıyız oran:
1 gr biyo-yağ -16,4 kJ
5 g biyo-yağ x
1. x = 5. (-16,4)
x = -82 kJ
Daha sonra alternatif C'yi işaretleyebiliriz.
Stéfano Araújo Novais tarafından
Kimya öğretmeni

