Sülfatlar, SO anyonunu içeren iyonik bileşiklerdir.42-sülfat anyonu olarak adlandırılır.
Sülfür, 16 veya VI-A ailesinin bir elementidir, yani değerlik kabuğunda 6 elektrona sahiptir. Oktet kuralına göre, son elektron kabuğunda 8 elektrona sahip olmak ve dolayısıyla kararlı olmak için 2 elektron daha alması gerekir. Ancak kükürt, Tablonun üçüncü periyodunda yer alan bir element olduğu için oktet genleşmesine uğrar. Periyodik, nispeten büyük olması, sekiz elektrondan fazlasını barındırmasına izin verir. etrafında.
Böylece, aşağıda görülebileceği gibi, kükürtün değerlik seviyesi, toplam 12 elektronu barındıracak şekilde genişler. Ancak iki oksijen atomu hala kararlı değil, her biri değerlik kabuğunda yedi elektrona sahip, bu nedenle stabilize etmek için bir elektron daha alması gerekiyor. Bu nedenle, bu iki atomun her birinin yükü -1'dir ve anyon için toplam yük -2'dir:
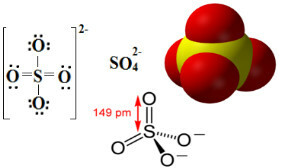
Sülfat anyonu, sülfürik asitten gelebilir (H2SADECE4(sulu)) aşağıda gösterilen:
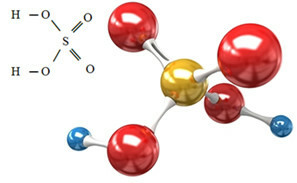
Sülfürik asit, nötralize edici bir reaksiyonda bazı bazlarla reaksiyona girerek sülfatımız olan inorganik bir tuz ve ayrıca su oluşturur:
Genel reaksiyon: Sülfürik Asit + Baz → Tuz (sülfat) + Su
H2SADECE4 + 2 Çoh →Ç2SADECE4+ 2 Saat2Ö
Potasyum sülfatın oluştuğu aşağıdaki örneğe bakın:
H2SADECE4 + 2 KOH →K2SADECE4+ 2 Saat2Ö
Bir sülfatın isimlendirilmesinin sadece kurala göre yapıldığını unutmayın: sülfat + ona bağlı elementin adı. Ek olarak, sülfat formülleri, element indeksi için her iyonun yükünü değiştirerek yapılır, "1" indeksinin yazılmasına gerek yoktur:
Örnekler:
at+1 SADECE42- → at2SADECE4→ sodyum sülfat
mg+2 SADECE42- → MgSO44→ magnezyum sülfat
Buraya+2 SADECE42- → Durum4→ kalsiyum sülfat
Ba+2 SADECE42- → BAZO4→ baryum sülfat
Al+3 SADECE42- → Al2(SADECE4)3→ alüminyum sülfat
Sülfat iyonu içeren tuzlar genellikle suda çözünür, istisnalar dörttür: kalsiyum sülfat (CaSO4), stronsiyum sülfat (SrSO4), baryum sülfat (BaSO4) ve kurşun sülfat (PbSO4). Bunun nedeni, bu katyonlar arasında yüksek bir bağlanma enerjisi olmasıdır (Ca2+, Bayım2+, Ba2+ ve Pb2+) ve sülfat, çünkü hepsinin +2 yükü ve sülfat anyonu -2 yükü vardır. Böylece, bu bağlantıyı koparmak daha zor hale gelir.
Sülfatlar, aşağıda bakır sülfat (CuSO4) durumunda gösterildiği gibi, zıt yüklerin birbirleri üzerine uyguladığı çekim nedeniyle kristal kafesler şeklinde bulunur.4):

Sülfatlar doğada esas olarak mineraller şeklinde bulunur. Bazı örneklere bakın:
barit → baryum sülfat;
alçıtaşı → kalsiyum sülfat;
Selestit → stronsiyum sülfat;
açıTAMAM MI → kurşun sülfat;
globerit → çift kalsiyum ve sodyum sülfat: CaNa2(SADECE4)2;
Potasyum şap (kalinit) → hidratlı çift potasyum alüminyum sülfat: KAL (SO4)2.11H2Ö
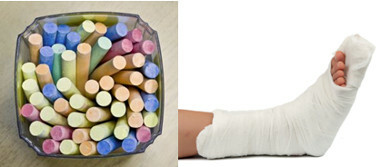
Günlük yaşamdaki ana sülfatlar arasında, okul tebeşiri üretiminde susuz formda (susuz) kullanılan kalsiyum sülfat var. Dihidrat formunda olduğunda (CaSO4 .2 saat2O), alçıtaşı olarak bilinir ve daha boldur. Isıtıldığında kalsiyum sülfat hemihidrat (CaSO4. ½H2O), ortopedi, diş kalıpları, inşaat ve boyalarda kullanılan alçıdır.
Bir diğer önemli tuz ise smagnezyum sülfat (MgSO44), s olarak bilinirMüshil etkisi olan ve masaj ve rahatlatıcı banyolar için kullanılan acı al veya Epsom tuzu.
Jennifer Foğaça tarafından
Kimya mezunu

