Asitler ve bazlar birbiriyle ilişkili iki kimyasal gruptur. Bunlar büyük öneme sahip ve günlük yaşamda mevcut olan iki maddedir.
Asitler ve bazlar, karbon tarafından oluşturulmayan bileşikleri inceleyen dal olan İnorganik Kimya tarafından incelenir.
Asitler ve Bazlar Kavramları
Arrhenius kavramı
Asit ve bazların ilk kavramlarından biri, 19. yüzyılın sonlarında İsveçli bir kimyager olan Svante Arrhenius tarafından geliştirildi.
Arrhenius'a göre asitler, sulu çözeltilerde zarar gören maddelerdir. iyonlaşma, sadece H+ katyonları olarak serbest bırakır.
HCl (sulu) → H+ (sulu) + Cl- (İşte)
Bu arada, bazlar acı çeken maddelerdir. iyonik ayrışmaOH- (hidroksil) iyonlarını tek anyon türü olarak serbest bırakır.
NaOH (sulu) → Na+ (sulu)+OH- (İşte)
Ancak, Arrhenius'un asitler ve bazlar kavramı suyla sınırlıydı.
Ayrıca şunları okuyun: Arrhenius Teorisi ve Nötrleştirme reaksiyonu.
Bronsted-Lowry Konsepti
Bronsted-Lowry kavramı, Arrhenius'unkinden daha geniştir ve 1923'te tanıtıldı.
Bu yeni tanıma göre asitler, proton H bağışlayabilen maddelerdir.
+ diğer maddelere. Ve bazlar, bir H protonunu kabul edebilen maddelerdir.+ diğer maddelerden.yani, asit bir proton donörüdür ve baz bir proton reseptörüdür.
karakterize eder güçlü asit suda tamamen iyonlaşan, yani H iyonlarını serbest bırakan biri olarak+.
Bununla birlikte, madde amfiprotik olabilir, yani bir madde gibi davranabilir. asit veya Bronsted tabanı. Su örneğine bakın (H2O), amfiprotik bir madde:
HNO3(su) + H2Ö(l) → HAYIR3- (sulu) + H3Ö+(aq) = Bronsted bazı, protonu kabul etti
NH3(su) + H2Ö(l) → NH4+(sulu) + OH-(sulu) = Bronsted asit, proton bağışladı
Ayrıca, maddeler gibi davranır eşlenik çiftler. Bir asit ve bir arasındaki tüm reaksiyonlar baz Bronsted, bir proton transferini içerir ve iki konjuge asit-baz çiftine sahiptir. Örneğe bakın:
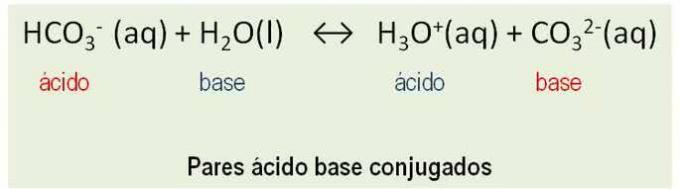
HCO3- ve CO32-; H2O ve H3Ö+ konjuge asit baz çiftleridir.
Hakkında daha fazla öğren:
- İnorganik Fonksiyonlar
- Asit-baz göstergeleri
- Titrasyon
asit terminolojisi
Adlandırmayı tanımlamak için asitler iki gruba ayrılır:
- Hidrasitler: oksijensiz asitler;
- Oksiasitler: oksijenli asitler.
Hidrasitler
Adlandırma şu şekilde gerçekleşir:
asit + element adı + hidrik
Örnekler:
HCl = hidroklorik asit
HI = hidriodik asit
HF = hidroflorik asit
oksiasitler
Oksiasitlerin isimlendirilmesi aşağıdaki kuralları takip eder:
Sen standart asitler her ailenin (Periyodik Tablonun 14, 15, 16 ve 17. aileleri) genel kuralı takip eder:
asit + element adı + ic
Örnekler:
HClO3 = klorik asit
H2SADECE4 = sülfürik asit
H2CO3: karbonik asit
Aynı çekirdek elementle oluşan diğer asitleri oksijen miktarına göre aşağıdaki kurala göre adlandırırız:
| Standart aside göre oksijen miktarı | isimlendirme |
|---|---|
| + 1 oksijen | Asit + başına + element adı + ico |
| - 1 oksijen | Asit + element adı + kemik |
| - 2 oksijen | Asit + hipo + element adı + kemik |
Örnekler:
HClO4 (4 oksijen atomu, standart asitten bir fazla): perklorik asit;
HClO2 (2 oksijen atomu, standart asitten bir eksik): klorlu asit;
HClO (1 oksijen atomu, standart asitten iki eksik): hipokloröz asit.
Ayrıca ilginizi çekebilir: sülfürik asit
Temel Adlandırma
Temel isimlendirme için genel kural izlenir:
Hidroksit + katyon adı
Misal:
NaOH = Sodyum hidroksit
Ancak aynı element farklı yüklere sahip katyonlar oluşturduğunda, iyonun yük sayısı Roma rakamlarıyla ismin sonuna eklenir.
Veya en az yüklü iyona -oso son ekini ve en yüklü iyona -ico son ekini ekleyebilirsiniz.
Misal:
Demir
inanç2+ = Fe(OH)2 = Demir II hidroksit veya Demirli hidroksit;
inanç3+ = Fe(OH)3 = Demir III hidroksit veya Ferrik hidroksit.
Konuyla ilgili giriş sınavı sorularını, yorumlanmış çözünürlükle birlikte kontrol ettiğinizden emin olun.: İnorganik fonksiyonlar üzerine alıştırmalar.