Ö Le Chatelier prensibi Bize dengedeki bir sistemde bir bozulmaya neden olduğunda, bu bozukluğun yarattığı kuvvetleri en aza indirecek yönde kayacağını ve yeni bir kimyasal dengeyi geri getireceğini söyler.
Bu rahatsızlıklardan biri, sıcaklık değişimi. Bu değişim önemlidir çünkü denge kaymasına neden olmasının yanı sıra denge sabiti K'nin değerini de değiştirecektir.ç.
Bunun nasıl olduğunu daha iyi anlamanız için bir örneğe bakalım:
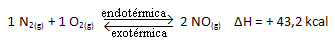
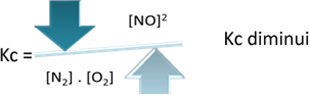
Kç = _[ THE]2___
[N2]. [Ö2]
Yukarıdaki reaksiyon, enerji emilimi ile doğrudan yönde gerçekleşir, endotermiktir. Ters süreç ise, ekzotermik bir reaksiyon olan enerjinin serbest bırakılmasıyla gerçekleşir.
Böylece, sistemin sıcaklığını arttırırsak, kimyasal denge, bu reaksiyonda sağda olan endotermik reaksiyona doğru kayar. Böylece ısı emilir ve denge yeniden sağlanır.
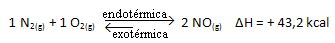
Bunun tersi de doğrudur; Bu sistemin sıcaklığını düşürürsek, reaksiyonun toplam enerjisi azalacağından, reaksiyon ısıyı serbest bırakacağı yöne kayar. Bu, dengenin, bu durumda sola doğru olan ekzotermik reaksiyona doğru kayacağı anlamına gelir:
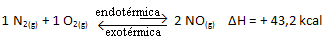
Kısacası:

Denge sabiti ile ilgili olarak (Kç), sıcaklık arttığında, endotermik reaksiyonu destekler ve daha fazla NO(g) oluşur, konsantrasyonunu arttırır ve reaktanların konsantrasyonunu azaltır. Aşağıdaki formülde NO konsantrasyonunun(g) sabit K ile doğru orantılıdırç, bu nedenle, aynı zamanda artar:
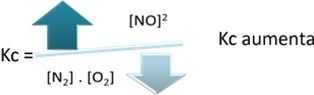
Ancak sıcaklığı düşürürsek, reaksiyonu ekzotermik reaksiyona kaydırırsak, NO ürününün konsantrasyonu azalacak ve reaktanların konsantrasyonları artacaktır. Tepkimeye girenlerin konsantrasyonları Kc sabiti ile ters orantılı olduğundan, azalacak:
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm
