Oksidasyon, atomların, iyonların veya moleküllerin elektron kaybettiği kimyasal reaksiyondur. Ayrıca oksidasyon (nox) sayısında artışa neden olur.
Oksidasyon terimi başlangıçta oksijenin reaktan olduğu reaksiyonları belirtmek için yaratılmıştır. Ancak bazı durumlarda bu unsurun yokluğunda meydana geldikleri tespit edilmiştir. Terim zaten yaygın olarak bilindiği için kullanılmaya devam etti.
Yükseltgenme reaksiyonları, indirgeme reaksiyonlarıyla aynı anda gerçekleşir. Bu nedenle elektronların aktarıldığı redoks olarak adlandırılırlar.
Redoks reaksiyonlarında, oksitleyici ajan, elektronları kabul eden ve indirgenen ajandır. İndirgeyici madde elektron kaybeder ve oksidasyona uğrar.
Oksidasyon Örnekleri
Demir Oksidasyonu
Pas, demirin oksidasyonudur. Tüm metaller oksidasyona uğrayabilir. Metallerin hava ve su ile teması sonucu oluşur. Başlangıçta, aşınma oksitlenme nedeniyle metalin aşınmasıdır. Daha sonra, pas.
tepkisini görmek redoks pas oluşumu için:
- Fe(ler) → Fe2+ + 2e-. Bu aşamada demir iki elektron kaybederek oksidasyona uğrar.
- Ö2 + 2 Saat2O + 4e- → 4OH-. O azaltma2
- 2Fe + O2 + 2H2O → 2 Fe(OH)2. Genel Denklem - Fe(OH)2 pasın kahverengi renginden sorumlu olan Demir Hidroksit'tir.
Demir ve çeliği oksidasyondan korumak için galvanizleme tekniği kullanılabilir. Metalik çinko kaplamadan oluşmaktadır. Ancak, pahalı bir işlemdir ve bazı durumlarda bunu olanaksız hale getirir.
Böylece gemi gövdeleri ve metal platformlar, demir oksidasyonunu önleyen metalik magnezyum blokları alır. Magnezyum, kurban bir metal olarak kabul edilir ve yıprandığında zaman zaman değiştirilmesi gerekir.
Boyama, metali oksidasyondan da koruyabilir, ancak o kadar etkili değildir.

Pas
Ayrıca hakkında okuyun Paslanmaz çelik ve Metal alaşımları.
Organik Kimyada Oksidasyon
Metallere ek olarak, oksidasyon ile de meydana gelebilir. hidrokarbonlar, özellikle de alkenler. Organik oksidasyonun dört formu vardır: yanma, ozonoliz, hafif oksidasyon ve enerji oksidasyonu.
Yanma
bu yanma ışık ve ısı üretimi ile sonuçlanan oksijen ile bir maddenin kimyasal reaksiyonudur. Oksijene oksitleyici denir. Karbon içeren madde yakıttır.
Oksijen, yakıtı oksitleme işlevine sahiptir, yanmanın oksitleyici maddesidir.
Yanma tam veya eksik olabilir. İki yol arasındaki farkı bilin:
- Tam yanma: Yeterli oksijen kaynağı olduğunda oluşur. Reaksiyonun sonunda karbondioksit (CO2) ve su (H2Ö).
- Eksik yanma: Yeterli oksijen kaynağı yoktur, oluşurlar. karbonmonoksit (CO) ve su (H2Ö).
ozonoliz
Bu tip reaksiyonda ozon, alkenlerin oksitlenmesine neden olan reaktiftir. Alkenlerin çift bağının kırılması ve aşağıdaki gibi karbonil bileşiklerinin oluşumu meydana gelir. aldehitler ve ketonlar.
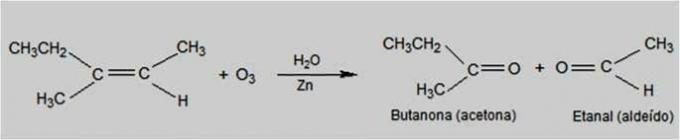
Ozonoliz Reaksiyonu
hafif oksidasyon
Oksitleyici ajan potasyum permanganat (KMnO) gibi bir bileşik olduğunda hafif oksidasyon meydana gelir.4), sulu bir çözelti içinde bulunur, seyreltilmiş ve soğutulmuş, nötr veya hafif bazik.
Bu tip oksidasyon, alkenleri izomerik siklanlardan ayırt etmek için kullanılan Baeyer Testi kullanılarak gerçekleşir.
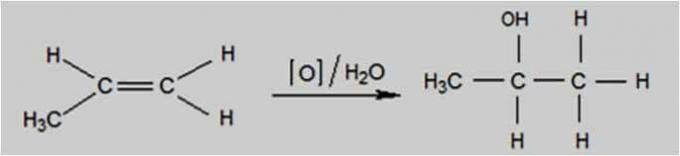
Hafif Oksidasyon Reaksiyonu
Enerji Oksidasyonu
Bu tip oksidasyonda potasyum permanganat daha sıcak ve asidik bir ortamda bulunur ve reaksiyonu daha enerjik hale getirir. Enerjik oksitleyici ajanlar, alkenlerin çift bağını kırabilir.
Alkenin yapısına bağlı olarak ketonlar ve karboksilik asitler oluşabilir.
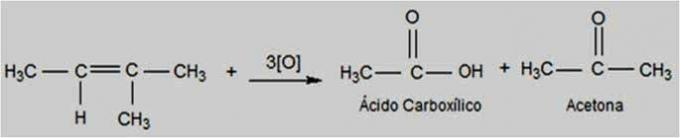
Enerji Oksidasyon Reaksiyonu
Daha fazlasını öğrenmek ister misiniz? Ayrıca hakkında okuyun elektrokimya.