Adı geçen elementler alkali toprak metalleri Periyodik Tablonun 2. veya IIA ailesine ait olanlardır. Bu grup aşağıdaki kimyasal elementleri içerir: Be (Berilyum), Mg (Magnezyum), Ca (Kalsiyum), Sr (Stronsiyum), Ba (Baryum) ve Radyum (Ra).

Değerlik kabuğunda iki elektronları vardır ve genel dağılımları ns2 ile temsil edilir, burada Hayır son seviyenin numarasını temsil eder. Bu özellik nedeniyle, bu iki elektronu kaybetme eğiliminde olup, 2+ yük katyonuna yol açarlar.
"Toprak" terimi, "yeryüzünde var olan" anlamına gelir, çünkü bu elementlerin esas olarak minerallerde bulunduğu yer burasıdır. Örneğin kalsiyum, kalsiyum fosfat bileşiği (Ca3(TOZ4)2), yerkabuğunda bulunur ve fosfor üretimi için hammadde görevi görür. Hayvanların kemiklerinde de o kadar bulunur ki, bunlar kalsine edildiğinde kalsiyum fosfat içeren “kemik unu” denilen şey elde edilir.
Alkali toprak metaller arasında en çok öne çıkanlar, Kalsiyum bu Magnezyum.
- Kalsiyum
Kalsiyum iyonu (Ca2+) kemiklerimizin ve dişlerimizin yaklaşık %90'ında bulunur; ve hayvanlarda da kabuklarında bulunur. İşlevi kemik yapısını güçlendirmek ve kas gevşetici görevi görmektir. Vücuttaki kalsiyum eksikliği kas kramplarına, tetanoza ve osteoporoza neden olabilir. Bu nedenle süt ve türevleri (tereyağı, peynir vb.), et ve sebzeler gibi kalsiyumdan zengin besinlerle tüketilmesi önemlidir.
Öte yandan, çok fazla kalsiyum kas gevşemesine, böbrek taşlarına ve kemik ağrısına neden olabilir.
Yukarıda belirtilen besinlere ek olarak, kalsiyum, doğanın birçok yerinde, özellikle kalsit (CaCO3) gibi minerallerde halen mevcuttur.3) veya kireçtaşı ve mermerin bir bileşeni olan kalsiyum karbonat ve lavabo, heykel, zemin ve merdiven imalatında mermer kullanılmaktadır. Kalsiyum karbonat ayrıca mağaralardaki sarkıt ve dikitlerin yapıcısıdır. Kalsiyum ayrıca doğal alçıda da bulunur (CaSO4. 2 saat2O), alçı denir. Bu tuz susuz kalarak CaSO'ya neden olabilir.4 okul tebeşiri olan susuz.
Sanayide, sönmüş kireç (CaO) üretilir, sönmüş kireç, sönmüş kireç veya sönmüş kireç olarak da adlandırılır, aslında kalsiyum hidroksittir (Ca (OH)2), badana boyalarında ve harç yapımında kullanılır. Alçının nazikçe ısıtılması, inşaatta kullanılan alçıtaşı olan hemihidratlı kalsiyum sülfatın elde edilmesini sağlar. Sivil toplum, Diş Hekimliği ve Tıpta, aşağıda gösterilen koldaki gibi kemik kırıklarını korumak için kalıp üretiminde.
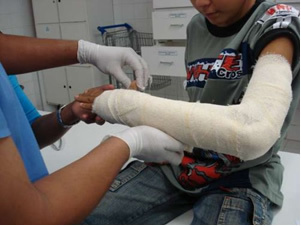
- Magnezyum
iyonu magnezyum Aynı zamanda, kemiklerimizin %70'inde bulunduğundan, enzimlerin, kasların ve motor koordinasyonun hareketini desteklediği için büyük biyolojik öneme sahiptir. Vücuttaki eksikliği, oryantasyon bozukluğuna, hipertansiyona, titremelere ve zayıf bir nabıza neden olabilir. Bu nedenle, bu elementi içeren şu yiyecekleri yemeliyiz: fındık, tahıllar ve yeşil sebzeler. Ayrıca vücuttaki fazla magnezyum uyuşukluğa neden olabilir.
Magnezyum ayrıca deniz suyunda ve minerallerde bulunur. Kurban metaller (çeliğin yerine oksitlenerek korozyonunu önleyen) gibi metalik alaşımlarda, “magnezyum” jantlarda ve havai fişeklerde (gümüş ve beyaz renkleri sunan) kullanılır. Magnezyumun çok önemli bir bileşiği magnezyum hidroksittir (Mg(OH)).2), su içinde dağıldığında, yaklaşık %7'lik bir konsantrasyonda bilinen bir süspansiyona yol açar. popüler olarak, bir antasit görevi gören, mide asiditesi (mide ekşimesi) ile savaşan ve müshil.

Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm


