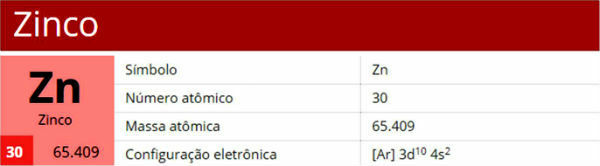
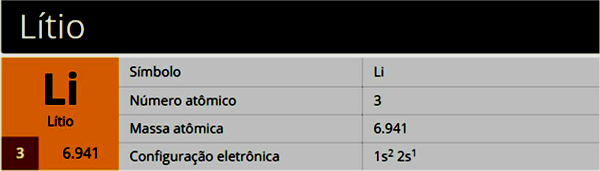
denir katmanlı elektronik dağıtım sadece miktarını dikkate alan dağıtım elektronlar katmanların her birinde maksimum (göre Bohr atomu) bir atomun.
Bir atomun sahip olabileceği katmanlar K, L, M, N, O, P ve Q'dur. Her birinde maksimum elektron miktarını görün:
K = 2 elektron
L = 8 elektron
M = 18 elektron
N = 32 elektron
O = 32 elektron
P = 18 elektron
Q = 8 elektron
gerçekleştirmek için katmanlarda elektronik dağıtım, bu gerekli:
Bununla Tanış atomik numara bu sayı elektron sayısını gösterdiğinden çalışılacak atomun;
Yukarıda açıklandığı gibi her kabuğun elektron limitine uyun.
Aşağıda önerilen kuralların her birini dikkatlice izleyin:
→ Kural 1: Elektron sayısı yeterliyse, atomun birinci (K-kabuğu) ve ikinci (K-kabuğu) kabuğu her zaman sırasıyla 2 ve 8 olan maksimum elektron sayısını almalıdır;
→ Kural 2: Elektronları alan sondan bir önceki kabuk asla 18 elektron sınırını aşamaz;
→ Kural 3: Elektronları alan son kabuk asla sekiz elektron sınırını aşamaz;
→ Kural 4: Son kabuğa sığabilecekten daha fazla elektron olduğunda, her zaman önceki kabuktaki elektron sayısını tekrarlamalı ve kalan elektronları bir sonraki kabuğa yerleştirmeliyiz.
Bazı örneklere bakın katmanlı elektronik dağıtım:
Örnek 1: Atom numarası 11 olan sodyum elementinin katmanlı dağılımı.
Sodyumun atom numarası 11 olduğu için atomlarının 11 elektronu vardır. Dağıtımı aşağıdaki gibi yapılacaktır:
Katman K: 2 elektron
On bir elektrondan K kabuğu, elektron limiti olduğu için sadece ikisini alacaktır. (Kural 1).
Katman L: 8 elektron
Kalan dokuz elektrondan L kabuğu, elektron limiti olduğu için sadece sekizini alacaktır. (kural 2).
Katman M: 1 elektron
Sodyum atomunun sahip olduğu on bir elektrondan yalnızca bir elektron kaldığı için, L kabuğundan sonraki M kabuğuna yerleştirilmelidir.
Şimdi durma... Reklamdan sonra devamı var ;)
Örnek 2: Atom numarası 20 olan kalsiyum elementinin katmanlı dağılımı.
Kalsiyumun atom numarası 20 olduğu için atomlarının 20 elektronu vardır. Katmanlar halinde dağılımı aşağıdaki gibi yapılacaktır:
Katman K: 2 elektron
20 elektrondan K kabuğu, elektron limiti olduğu için sadece 2 elektron alacaktır. (Kural 1).
Katman L: 8 elektron
Kalan 18 elektrondan L kabuğu, elektron limiti olduğu için sadece 8'ini alacaktır. (kural 2).
Katman M: 8 elektron
K ve L kabukları doldurulduktan sonra geriye 10 elektron kalır. Son kabuk sekizden fazla elektrona sahip olamayacağından, önceki kabuktan (L kabuğu) elektron sayısını tekrarlamalı ve geri kalanını bir sonraki kabuğa (N kabuğu) yerleştirmeliyiz. (kural 4).
Katman N: 2 elektron
Önceki katmana yerleştirilemedikleri için kalan elektronları alır (kural 4).
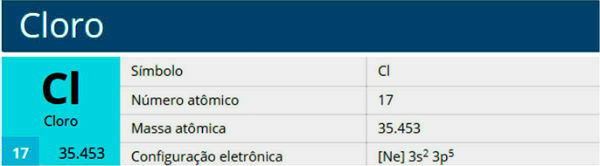
Örnek 3: Atom numarası 35 olan brom elementinin katmanlı dağılımı.
Bromun atom numarası 35 olduğu için atomları 35 elektrona sahiptir. Dağıtımı aşağıdaki gibi yapılacaktır:
Katman K: 2 elektron
35 elektrondan K kabuğu, elektron limiti olduğu için sadece 2 elektron alacaktır.
Katman L: 8 elektron
Kalan 33 elektrondan L kabuğu, elektron limiti olduğu için sadece 8 elektron alacaktır.
Katman M: 18 elektron
Geriye 25 elektron kaldığı için bu kabuk sonuncusu olmayacağından sadece 18 elektron alabilir, sonuncusu sadece 8 alabilir, sondan ikinci ise 18 elektron alabilir. Böylece, M katmanı sondan bir önceki katman olacaktır. (kural 3).
Katman N: 7 elektron
Atomun sahip olduğu 35 elektrondan sadece yedi tanesi kalır. Son kabuk sekiz elektron alabildiğinden, bu son kabuk olacak ve yedi elektron alacak.
Benden Diogo Lopes Dias
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
GÜNLER, Diogo Lopes. "Elektronik katmanlı dağıtım"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-camadas.htm. 28 Haziran 2021'de erişildi.
Kimya

Niels Bohr, Bohr atomu, atom fiziği, kararlı atom, atom modeli, gezegen sistemi, elektrosferin katmanları, enerji seviyeleri, elektron kabukları, elektron enerjisi, Rutherford atom modeli, uyarılmış durum atomu.