Hess yasası, İsviçreli kimyager Germain H. Termokimyanın kurucularından biri olarak kabul edilen Hess (1802-1850). Onun kanunu dedi ki:

Yani, ΔH, ifadede olduğu gibi yalnızca reaktiflerin ve ürünlerin entalpi değerlerine bağlıdır:
| ΔH = ΔHreaktifler + ΔHÜrün:% s |
Örneğin, 1 mol suyun (H2O) gaz halinde suya dönüşür. Bu reaksiyon iki kez gerçekleştirilir; ancak farklı yollar seçildi:
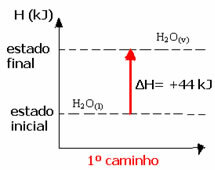
(1.) Tek adımda gerçekleştirildi:
H2Ö(1) → H2Ö(v) ΔH= +44 kJ
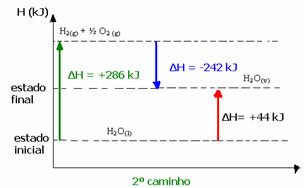
(2.) İki aşamada gerçekleştirildi:
1. adım: H2Ö(1) → H2(g) + ½2 (g) ΔH= +286 kJ
2. aşama: H2(g) + ½2 (g) → H2Ö(v) ΔH= -242 kJ
H2Ö(1) → H2Ö(v) ΔH= +44 kJ
Şimdi durma... Reklamdan sonra devamı var ;)
Bir veya iki adımın gerçekleştirilip gerçekleştirilmediğine bakılmaksızın, entalpi değişiminin (ΔH) her zaman 44 kJ olduğuna dikkat edin. Bunun nedeni, ΔH'nin süreci oluşturan adımların, yani ara süreçlerin valoresH değerlerinin cebirsel toplamı olmasıdır:
| ΔH = ΔH1 + ΔH2 + ΔH3 + ... |
Örneğin, ikinci durumda, reaksiyonun toplam ΔH'si, birinci adımın ΔH'sinin (ΔH= +286 kJ) ve ikincininkinin (ΔH= -242 kJ) toplamıydı. Böylece tek adımda aynı reaksiyon değerini elde ettik:
ΔH = (+286 + (-242)) kJ
ΔH = (+286 -242) kJ
ΔH = +44 kJ
Bu nedenle, yalnızca başlangıç ve son değerlerle ilgileniyoruz. Bu durumda, başlangıç durumu H'ye karşılık gelir.2Ö(1) ve H'nin sonu2Ö(v).
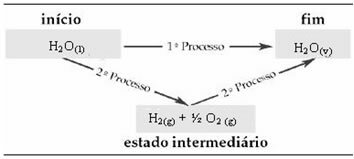
Bu yasa Termokimyada çok önemli hale gelmiştir, çünkü bazı kimyasal tepkimelerde ΔH deneysel olarak belirlenemez. Bununla birlikte, Hess Yasasına göre, bu tür bir reaksiyonun entalpisi, diğer reaksiyonların (ara reaksiyonlar) entalpilerinden hesaplanabilir.
Jennifer Foğaça tarafından
Kimya mezunu
Brezilya Okul Takımı
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Hess Yasası"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/lei-hess.htm. 28 Haziran 2021'de erişildi.


