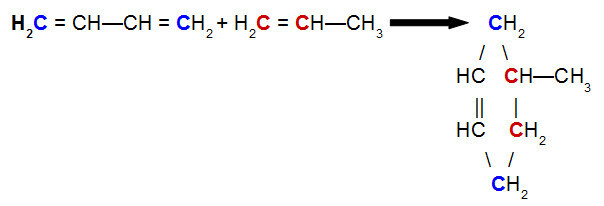Bir reaksiyonu kanıtlayan şey, maddelerde başlangıç durumlarına göre meydana gelen dönüşümdür, bu modifikasyonlar, reaktanların geçeceği reaksiyonun türüne bağlıdır.
Kimyasal reaksiyonları sınıflandırmak için birkaç kriter vardır, bunlardan biri reaksiyona giren maddelerin sayısı (reaktanlar) ve üretilen maddelerin sayısı (ürünler) ile ilgilidir. Daha iyi açıklamak için harfleri kullanacağız: bu, B, Ç, X, Y.
Sentez veya ekleme reaksiyonu: iki veya daha fazla maddenin tek bir üründen kaynaklandığı maddelerdir.
A + B → Ç
Bu reaksiyona örnek: magnezyum havadaki oksijenle reaksiyona girdiğinde:
2Mg(s) + 1 O2(g) → 2MgO(lar)
Bu reaksiyon, tek kullanımlık fotoğraf flaşlarında ve sinyal roketlerinde bulunur.
Analiz veya ayrışma reaksiyonu: bu reaksiyonda tek bir madde iki veya daha fazla ürün üretir.
bu → B + C
Bazı reaksiyonlara özel isimler verilir:
Elektroliz: maddeler elektrik akımının geçmesiyle ayrışır.
fotoliz: ışıkla kimyasal ayrışma.
piroliz: ısı ve ateşin etkisiyle bozunma.
Örnek: Hava yastıkları birçok arabada bulunan güvenlik cihazlarıdır. Bu cihazı tetiklediğimizde, NaN sodyum bileşiğinin hızlı ayrışması
Şimdi durma... Reklamdan sonra devamı var ;)
2 NaN3(ler) → 3 N2(g) + 2 Na(s)
Basit değişim veya yer değiştirme reaksiyonu: basit bir maddenin bir bileşikle reaksiyona girerek yeni maddeler meydana getirmesi durumunda oluşur: bir basit ve bir bileşik.
A + XY → Y+X
Örnek: Sulu bir hidroklorik asit çözeltisine bir çinko tabakası eklendiğinde, çinko klorür oluşacak ve hidrojen gazı açığa çıkacaktır.
Zn(s) + 2 HCl (sulu) → ZnCl2(sulu) + H2 (g)
Çinkonun Hidrojen ile yer değiştirdiğini, dolayısıyla “yer değiştirme reaksiyonu” adını aldığını unutmayın.
çift değişim reaksiyonu: iki reaktif iki ürün oluşturarak reaksiyona girer, yani iki bileşik madde reaksiyona girerek yeni bileşik maddelere yol açarsa, bu adı alırlar.
AB + XY → Y+XB
Örnek: Sülfürik asit ile baryum hidroksit arasındaki reaksiyon, su ve baryum sülfat üretir.
H2SADECE4 (sulu) + Ba(OH)2(sulu) → 2 H2O(1) + BaSO4(ler)
Baryum sülfat ürünü: BaSO4(s) çözünmeyen beyaz bir tuzdur.
Líria Alves tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
SOUZA, Liria Alves de. "Kimyasal Reaksiyon Türleri"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/tipos-reacoes-quimicas.htm. 27 Haziran 2021'de erişildi.