Ö sodyum klorit (sofra tuzu) günlük hayatımızda el yapımı veya işlenmiş (sanayileşmiş) gıdaları tuzlamak için kullandığımız tuzdur. Meyveler, sebzeler, baklagiller, tohumlar gibi günlük olarak tükettiğimiz çeşitli doğal gıdalarda da bulunan bir maddedir.
Bu metinde, insanın günlük yaşamı için bu önemli madde hakkında her şeyi bileceksiniz:
tanım
Sodyum klorür, tuzların inorganik işlevine aittir ve sodyum katyonunun (Na+) bu anyon cOradaoreto (Cl-) aracılığıyla iyonik bağ.
b) Kimyasal özellikler
Sodyum klorür iki kimyasal elementten oluşur:
→ Sodyum (Na):
metal ailesine aittir (kolayca katyon oluşturabilen) alkalin (AI);
değerlik kabuğunda bir elektrona sahiptir;
atom numarası 11'e eşittir;
yüksek elektropozitifliğe sahiptir (elektron kaybetme yeteneği).
→ Klor (Cl)
halojenler (VIIA) ailesine aittir;
ametaldir (bu yüzden bu kadar kolay bir anyon haline gelir);
değerlik kabuğunda yedi elektrona sahiptir;
atom numarası 17'ye eşittir;
yüksek elektronegatifliğe sahiptir (elektron kazanma yeteneği).
Sodyum klorürü oluşturan iki kimyasal element sırasıyla yüksek elektropozitiflik ve yüksek elektronegatiflik, aralarında iyonik bir bağ vardır (kaybetme ve kazanma eğilimi olan atomlar arasında kurulur) elektronlar).
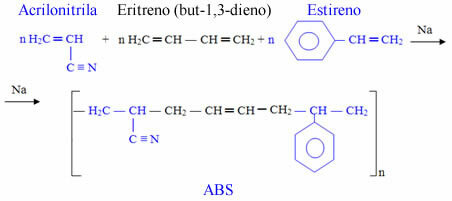
Sodyum klorürün kimyasal yapısı, aşağıdaki yapıda görülebileceği gibi, altı sodyum katyonu (mavi küre) ile etkileşime giren tek bir klorür anyonundan (yeşil küre) oluşur:

Sodyum klorürün kristal yapısının temsili
c) Fiziksel özellikler
Füzyon noktası:
Sodyum klorür, 801 °C sıcaklıkta katı halden sıvı hale dönüştürülebilir. ÖÇ.
Kaynama noktası:
Sodyum klorür, 1465 sıcaklıkta sıvı halden gaz haline dönüştürülebilir. ÖÇ.
Polarite
İyonik bağdan oluşan bir madde olduğu için yani iyonik bir bileşik olduğu için sodyum klorür polardır.
sudaki çözünürlük
25°C'de 1 L suda çözebiliriz. ÖC, 359 grama kadar sodyum klorür.
Diğer çözücülerde çözünürlük:
Sodyum klorür polar bir bileşik olduğundan, yağ gibi polar olmayan herhangi bir çözücüde çözülemez.
Yoğunluk:
Sodyum klorürün yoğunluğu 2.165 g/mL'dir, bu nedenle yoğunluğu 1 g/mL'ye eşit olan sudan daha yoğundur.
Elektiriksel iletkenlik:
İyonik bir bileşik olduğundan, sodyum klorür yalnızca şu durumlarda elektrik akımı iletebilir:
-
Erimiş halde yani sıvı haldedir;
Şimdi durma... Reklamdan sonra devamı var ;)
Suda çözülür.
d) Elde etme yöntemleri
Sodyum klorür fiziksel veya kimyasal olarak elde edilebilir:
1Ö) Fiziksel olmak:
fraksiyonel kristalizasyon
Sodyum klorür okyanuslardaki suyun buharlaştırılmasıyla elde edilir.
yeraltı madenleri
Madencilik teknikleri kullanılarak madenlerde çıkarılır.
yeraltı yatakları
Derin yeraltı birikintilerinden suda çözülerek (depozitte bulunan tuz çözülür) ve ardından pompalanarak çıkarılır.
2Ö) Kimyasal olarak elde edilmesi
sentez reaksiyonu
Sodyum klorür, klor gazı ve metalik sodyum arasındaki sentezin kimyasal reaksiyonundan (basit maddeler bir bileşik maddeye yol açar) elde edilebilir:
2 İçinde(ler) + Cl2(g) → 2 NaCl(ler)
Nötrleştirme reaksiyonu:
Sodyum klorürü kimyasal olarak elde etmenin bir başka yolu, tuz ve su oluşumuna sahip olduğumuz hidroklorik asit ve sodyum hidroksit arasındaki nötralizasyon reaksiyonudur:
HCl(1) + NaOH(İşte) → NaCl(İşte) + H2Ö(1)
e) İnsan için önemi
Sodyum klorürün insan vücudunda tek başına bir işlevi yoktur, ancak sodyum katyonlarına (Na) ayrıştığında+) ve klorür anyonları (Cl-), bu iki iyonun her birinin vücudumuz için birkaç önemli işlevi vardır. Bu işlevlerden bazılarına bakın:
→ Sodyum katyonunun işlevleri (Na+)
Kanın pıhtılaşmasını önler;
Böbrek ve safra taşı oluşumuyla savaşır;
Vücut sıvılarının düzenlenmesinde görev alır;
Kan basıncının düzenlenmesinde görev alır.
→ Klorür anyonunun işlevleri (Cl-)
Mide suyunun oluşumuna ve oluşumuna katılım (hidroklorik asit -HCl);
Pankreas suyu oluşumuna katılım.
f) İnsan vücudunda hasar
Aşırı sodyum klorür tüketimi insanlara aşağıdaki zararlara neden olabilir:
→ Vücuttaki fazla sodyum katyonlarının neden olduğu hasarlar:
Artan yara iyileşme süresi;
Artan insidans kramplar;
Artan kan basıncı;
Böbrek aşırı yüklenmesi;
Vücutta artan sıvı tutulması.
→ Vücuttaki fazla klorür anyonlarının neden olduğu hasar:
yıkımı E vitamini;
Vücutta iyot üretiminde azalma.
g) Diğer uygulamalar
Sodyum klorür, yiyecekleri tuzlamak için kullanılmasının yanı sıra aşağıdaki durumlarda da kullanılabilir:
Şampuan üretimi;
Kağıt üretimi;
Üretimi Sodyum hidroksit (NaOH);
Deterjan üretimi;
Sabun üretimi;
Kar fırtınası olan yerlerde kar erimesi;
Metalik sodyum üretimi;
Klor gazı üretimi;
Vücut elektrolit değişimi için izotonikte;
Nazal dekonjestan solüsyonlarda;
Tuzlu su çözeltisi üretimi; diğer uygulamalar arasında.
Benden Diogo Lopes Dias
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
GÜNLER, Diogo Lopes. "Sodyum klorür (sofra tuzu)"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. 27 Haziran 2021'de erişildi.
İyonik bileşikler, iyonik bileşiklerin temel özellikleri, iyonlar arası bağ, kesin elektron transferi, iyonlar arasındaki elektrostatik çekim kuvvetleri, negatif ve pozitif iyonlar, anyonlar, katyonlar, iyonik bağ, moleküler yapı o
Kimya

İyonik bağ, iyonik bileşikler, iyonik aglomeralar, sodyum klorür, sofra tuzu, iyonik madde arasındaki düzenlemeler, elektrostatik çekim kuvvetleri, klorür anyonları, sodyum katyonları, polar çözücüler, pozitif iyonlar, katyonlar, negatif iyonlar, anyonlar.