Eter oksijenli bir organik fonksiyondur, yani karbon ve hidrojene ek olarak oksijen kimyasal elementine sahiptir. Bu işlevin ana yapısal özelliği iki varlığın varlığıdır. organik radikaller bir oksijen atomuna bağlıdır.
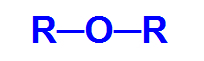
Bir eterin genel yapısal formülü
Bu nedenle, bir eterin karbon zinciri heterojendir ve iki özdeş veya farklı radikale sahip olabilir. alkil, aromatik yapıya sahip olmayan radikal türleri veya aril, yapıya sahip olmayan radikaller aromatik.
Eterin fiziksel özellikleri
Oda sıcaklığındaki fiziksel duruma gelince: eter bileşiminde dört veya daha fazla karbon atomu vardır, sıvıdır;
Erime noktası ve kaynama noktasına gelince: diğer kütle organik bileşiklerle karşılaştırıldığında yaklaşık molar, alkanlarınkine benzer bir erime noktasına sahip ve diğer bileşiklerden daha düşük organik;
Yoğunluğa gelince: su ile karşılaştırıldığında küçük bir yoğunluğa sahip bileşiklerdir;
Etkileşim kuvvetlerine gelince: eterler, zayıf bir kalıcı dipol etkileşimi yoluyla birbirleriyle etkileşime giren düşük polarite ile oluşur. Su ve alkoller ile eterler, hidrojen bağları yoluyla etkileşime girme yeteneğine sahiptir.
gelince polarite: açısal geometriye sahip bileşiklerdir, dolayısıyla polardırlar.
Organoleptik özelliğe gelince: çok hoş bir koku yayan maddelerdir, ancak solunmaları bağımlılığa neden olabilir.
Eterin resmi isimlendirmesi
Küçük kök öneki + oksi + ana kök öneki + iç ek + o
Bir resmi isimlendirmeyi yürütmek için eter, Hangisinin majör ligandınızın hangisinin minör ligandınız olduğunu belirlemek çok önemlidir. Bunu yapmak için, aşağıdaki bu adlandırma kuralı için iki uygulama örneğini izleyin:
1. Örnek:
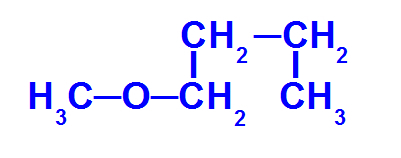
Daha az karbonlu bir eterin yapısal formülü
Yukarıdaki eter aşağıdaki radikallere sahiptir:
Metil (CH3-);
Bütil (CH3-CH2-CH2-CH2-).
Bu bileşiği adlandırmak için elimizde:
minör radikal önek: Met
+
oksi
+
ana kök öneki: ancak
+
an (çünkü yalnızca tek bağlantıları vardır)
+
Ö
Yani bunun adı eter metoksibütan olacaktır.
2. Örnek:
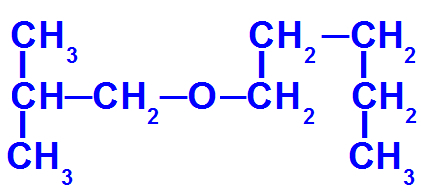
Daha fazla karbon içeren bir eterin yapısal formülü
Bu eter aşağıdaki radikallere sahiptir:
İzobütil [(CH3)2-CH-CH2-);
pentil (CH3-CH2-CH2-CH2-CH2).
Bu nedenle, adlandırmak için elimizde:
küçük radikal önek: isobut
+
oksi
+
ana kök öneki: pent
+
an (çünkü yalnızca tek bağlantıları vardır)
+
Ö
Böylece, kurumun adı eter söz konusu izobutoksipentan olacaktır.
Her zamanki eter isimlendirmesi
Eter + radikallerin adı (en basit ve sonra en karmaşık) + ico
veya
Radikal isimler + eter
Bu adlandırma kuralı için aşağıdaki iki uygulama örneğini izleyin:
1. Örnek:

Dört karbonlu bir eterin yapısal formülü
bu eter aşağıdaki radikalleri sunar:
Metil (CH3);
izopropil (CH3-CH-CH3).
Yani, bu bileşik için elimizde:
Eter
+
minör radikal: Metil
+
ana radikal önek: izopropil
+
ich
Böylece, kurumun adı eter söz konusu metil izopropil eter veya metil izopropil eter olacaktır.
2. Örnek:

Beş karbonlu bir eterin yapısal formülü
Yukarıdaki eter aşağıdaki radikallere sahiptir:
etil (CH3-CH2-);
propil (CH3-CH2-CH2-).
Bu bileşiği adlandırmak için elimizde:
Eter
+
minör radikal: etil
+
ana radikal önek: propil
+
ich
Böylece, kurumun adı eter söz konusu olan, etil propil eter de olabilen etil propil eter olacaktır.
Eterlerin kullanımları
Genel olarak, eterler kullanılır:
İnert organik çözücüler olarak yani herhangi bir reaksiyona katılmazlar;
Çiçek, ağaç vb. esansların çıkarılmasında kullanılır;
Çeşitli sıvı ve katı yağların ekstraksiyonunda kullanılır.
Benden. Diogo Lopes
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eter.htm
