Texten Tilläggsreaktioner visade att dessa typer av organiska reaktioner namnges på detta sätt eftersom en reaktant tillsätts till den organiska molekylen genom att bryta bindningar mellan kol. I denna text visades fallet med alkener, här kommer vi redan att överväga hur detta sker med alkyner, eller det vill säga med de kolväten (endast består av kol- och väteatomer) som har en bindning trippel.
Den sårbara punkten för alkyner är exakt trippelbindningen, där pi (π) -typbindningar kan brytas en (tillsats partiell) eller två gånger (total tillsats) och ger upphov till nya föreningar med dubbel (alkener) eller enkelbindningar (alkaner).
Låt oss titta på fallen av additionsreaktioner i alkyner:
1. Tillsats av väte eller hydrogenering:
I detta fall är H-molekylen2 sätts till alkyn med användning av en katalysator, som vanligtvis är pulveriserat nickel (Ni), platina (Pt) eller palladium (Pd). På grund av behovet av att använda en katalysator kallas denna reaktion också katalytisk hydrering och det sker i steg: i det första steget får du en alken och i det andra steget, som är långsammare, får du en alkan.
Om den använda katalysatorn är stark, såsom nickel och platina, alstras reaktionen direkt alkanen. Palladium blandat med BaSO4 den är en svag katalysator och producerar alken. Det är också möjligt att använda en partiell katalysatorinhibitor för att endast nå upp till alkenet. Denna reaktion äger rum också under höga tryck och temperaturer.
Därefter har vi tillsatsen av väte till etan, vilket producerar eten och sedan etan:

2. Tillsats av halogener eller halogenering:
En alkyne-pi-bindning bryts och två halogenatomer tillsätts till molekylen (element från 17A-familjen i det periodiska systemet, den mest använda är: Cl2 och Br2bildar en vicinal dihalogenid, vilket betyder att två halogenatomer är bundna till angränsande kolatomer. Reaktionen kan fortsätta, bryta den andra pi-bindningen och tillsätta ytterligare två halogenatomer till molekylen.
I exemplet nedan har vi denna typ av tillägg till mutan:
ClCl ClCl
││ ││
H ─C ≡ C CH3 + Cl2 → H ─ C ═ C CH3 + Cl2 → H ─ C ─ C CH3
││
ClCl
ALCINO DI-HALETTE TETRAHALETTE
3. Tillsats av vätehalogenider (halogenhydrider eller hydrohalogenering):
Här tillsätts en vätehalogenid till alkynen och partiell och total tillsats kan också äga rum. En viktig aspekt av denna typ av reaktion är att den följer Markovnikovs styre, dvs väte binder till det mer hydrerade kolet (med fler väteatomer bundna) och halogen binder till det mindre hydrerade kolet.
Vid total hydrohalogenering bildas en gemisk dihalogenid, det vill säga en förening som har två halogenatomer bundna till samma kol.
Sluta inte nu... Det finns mer efter reklam;)
Kolla på:
HBr Hbr
││ ││
H ─C ≡ C CH3 + HBr → H ─ C ═ C CH3 + HBr → H ─ C ─ C CH3
││
Hbr
ALKINOHALIDGEMISK DI-HALOGID
Ett viktigt exempel på denna typ av reaktion är den som inträffar när väteklorid tillsätts till etyn och bildar kloreten eller vinylmonoklorid, som är monomeren som bildar polyvinylkloridpolymeren, bättre känd under dess akronym PVC.
HClHCl
││ ││
H ─C ≡ C ─ H + HCl → H ─ C ═ C ─ H + HCl → H ─ C ─ C ─ H
││
HCl
ETINOKLOROETEN 1,1-DIKLOROETAN
(PVC-monomer)
PVC är ett ämne som ofta används inom industrin för tillverkning av olika produkter, såsom sandaler, medicinflaskor, medicintekniska produkter, plastbyxor för spädbarn, väskor, trådbeläggningar, leksaker, möbelklädsel, bilklädsel, regnrockar, plastskor, vinylskivor, golv, förpackningsfilmer, rör som används i vattenledningar och avlopp etc.
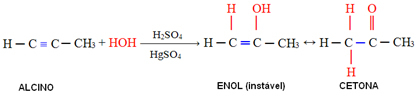
4. Tillsats av vatten (hydratisering):
I denna reaktion reagerar vatten med alkyn och bildar initialt en enol, som genomgår en molekylär omläggning och förvandlas till aldehyd (i fallet med alkyner som är mindre än acetylen). Enol och aldehyd förblir i dynamisk jämvikt med övervägande av aldehyd. Detta är ett fall av Dynamisk konstitucikonal isomery eller tautomery.
Exempel:

När det gäller alkyner som är större än acetylen följs Markovnikov-regeln och enol ger upphov till en keton:
Av Jennifer Fogaça
Examen i kemi


