I vardagen och i laboratorierna finns reaktioner och transformationer som är spontana och andra som inte är spontana. Till exempel är all förbränning en spontan reaktion, för när den väl startat kommer den att fortsätta tills allt bränsle förbrukas eller tills allt syre är borta.
Å andra sidan är elektrolys en icke-spontan process där elektrisk energi omvandlas till kemisk energi. Ett exempel är elektrolys av natriumklorid (NaCl). När en elektrisk ström passerar över detta smälta salt uppstår redoxreaktioner och bildandet av metalliskt natrium (Na(s)och klorgas (Cl2 (g)). Om vi slutar köra elektrisk ström fortsätter reaktionen inte på egen hand, vilket visar att den inte är spontan.
En reaktions spontanitet kan mätas med hjälp av Gibbs-Helmholtz ekvation, ges nedan:

På vad:
∆G = variation av fri energi;
∆H = entalpiförändring;
T = temperatur i Kelvin (alltid positiv);
∆S = entropiändring.
Denna ekvation tar sitt namn eftersom den föreslogs av den amerikanska fysikern J. Willard Gibbs (1839-1903) och av den tyska fysikern Hermann Helmholtz (1821-1894).
För att bättre förstå hur denna ekvation hjälper oss att bestämma spontaniteten i en reaktion, låt oss kort granska vart och ett av de begrepp som är involverade i den:
- ∆H (entalpi-variation): Enthalpy (H) är ett ämnes energiinnehåll. Hittills är inget sätt att bestämma det känt. I praktiken är det som uppnås att mäta entalpivariationen (∆H) i en process med hjälp av kalorimetrar. Denna variation är mängden energi som släpptes ut eller absorberades i processen.
- ∆S (entropi variation):Entropi (S) är den termodynamiska storleken som mäter graden av störning i ett system.
Till exempel, vid smältande is, rör sig molekyler från ett fast till flytande tillstånd, där det finns större desorganisation. Detta innebär att entropin ökade i denna process (∆S> 0).
Sluta inte nu... Det finns mer efter reklam;)
Vid produktion av ammoniak (NH3), 1 mol kvävgas reagerar med 3 mol vätgas (det vill säga 4 mol molekyler i reaktanterna), vilket ger upphov till 2 mol ammoniak:
N2 (g) +3 H2 (g) → 2 NH3 (g)
Eftersom antalet molekyler i gasfasen minskar i denna process minskade desorganisationen, vilket innebär att entropin också minskade (∆S <0).
- ∆G (fri energi): Fri energi eller Gibbs fri energi (eftersom det bara föreslogs av denna forskare 1878) är den användbara energin i systemet som används för att utföra arbete.
Ett system har global energi, men bara en bråkdel av den energin kommer att användas för att göra arbete, detta kallas Gibbs fri energi, symboliserat av G.
Enligt Gibbs, en process anses spontan om den utför arbete, det vill säga om G minskar. I det här fallet kommer transformationens slutliga tillstånd att vara mer stabilt än det initiala när ∆G <0.
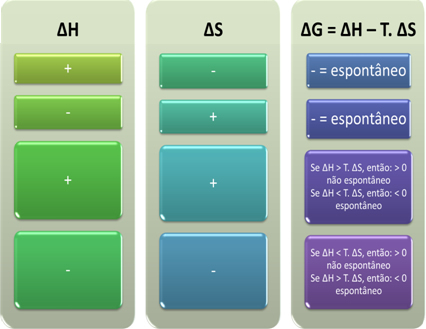
Baserat på detta kan vi dra följande slutsatser:

Vi kan också se om en process blir spontan genom att titta på det algebraiska tecknet på ofH och ∆S i Gibbs-Helmholtz-ekvationen:
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Gibbs Free Energy"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm. Åtkomst den 28 juni 2021.