DE auto-oxi-reduktion eller oproportionerlig reaktion är en typ av redoxreaktion där samma kemiska grundämne genomgår oxidation och minskning. Låt oss titta på två exempel på denna typ av reaktion och hur man balanserar dem med redoxmetoden:
1: a exemplet:
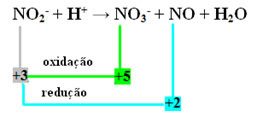
VID2- + H+ → NEJ3- + NO + H2O
- Genom att beräkna oxidationsantalet (NOX) för alla atomer och joner som är inblandade i reaktionen är det möjligt att verifiera vem som oxiderade och vem som reagerade:
+3 -2 +1 +5 -2 +2 -2 +1 -2
VID2- + H+ → NEJ3- + NO + H2O
- Observera att kväve var den art som både reagerade och oxiderade:
- För att balansera denna reaktion med redox måste vi relatera NOX till produkterna, inte reagenserna:
VID3- = ∆Nox = 5 - 3 = 2
NO = ∆Nox = 3 - 2 = 1
- Invertera ∆NOX med koefficienterna, vi har:
VID3- = ∆NOX = 2 → 2 kommer att vara koefficienten för NO
NO = ∆NOX = 1→ 1 kommer att vara koefficienten för NO3-
VID2- + H+ → 1 VID3- + 2 NO + H2O
- Med detta vet vi redan att det finns 3 N i produkten, så koefficienten NO2- blir 3:
3 NEJ2- + H+ → 1 NEJ3- + 2 NO + H2O
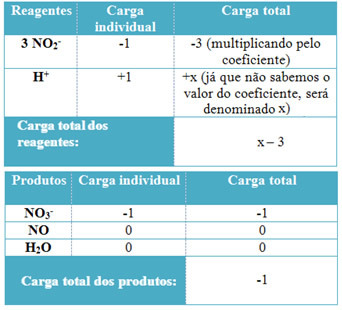
- För att bestämma koefficienterna för H+ och från H2O, kom ihåg att antalet mottagna elektroner motsvarar samma mängd donerade elektroner; sålunda kommer reagensladdningen att vara lika med produktladdningen. På detta sätt kan vi göra följande schema:
Sluta inte nu... Det finns mer efter reklam;)
Baserat på denna information har vi att reagensens totala laddning är lika med x - 3 och produkten är lika med -1. Som sagt måste anklagelserna för de två vara lika. Eftersom vi redan har den totala mängden produkter kan vi göra en enkel beräkning för att veta vad värdet på x kommer att vara:
x -3 = -1
x = -1 +3
x = 2
Således är koefficienten för H+ är 2 och följaktligen den för H2Det blir 1:
3 NEJ2- + 2 H+ → 1 NEJ3- + 2 NO + 1 H2O
2: a exempel:
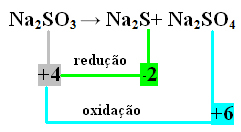
I det här fallet var det S som genomgick reduktion och oxidation samtidigt. Såsom tidigare gjort kan vi relatera NOX till produkterna och invertera deras värden genom att tilldela koefficienterna till dem:
På2 S = ∆Nox = 4 - (-2) = 6 → 6 kommer att vara koefficienten för Na2 ENDAST4
På2 ENDAST4= ∆Nox = 6-4 = 2 → 2 kommer att vara koefficienten för Na2 s
På2 ENDAST3→ 2 På2 Y + 6 På2 ENDAST4
Eftersom det finns 8 svavlar i den andra delen, är Na-koefficienten2 ENDAST3 blir 8:
8 in2 ENDAST3→ 2 In2 S + 6 In2 ENDAST4
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Självoxideringsreaktioner"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Åtkomst den 28 juni 2021.