Gymnasieelever är alltid föremål för ansikte redoxreaktioner med joner, både i inträdesprov och vid National High School Examination (Enem). Att balansera dessa ekvationer kan således vara ett mycket fruktat ämne.
För att underlätta förståelsen av detta ämne, försöker denna text ta itu med balansering av redoxekvationer med joner med beskrivningen av några steg för att genomföra det. För detta måste vi börja med att identifiera denna typ av kemisk reaktion.
På redoxreaktioner med joner identifieras genom närvaron av en eller flera komponenter med laddningar (positiva eller negativa), det vill säga joner (katjoner eller anjoner), som kan förekomma i reagens eller produkter, som i de två exemplen a Följ:
1: a exemplet:Cr2O72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
2: a exempel:Cl2 + C + H2O → CO2 + H+ + Cl-
Att genomföra balansera ekvationer av redoxreaktioner med joner, det är viktigt att följa några steg, till exempel:
Första steget: bestäm NOX av vart och ett av reaktanternas atomer och ekvationens produkter;
Andra steget: kontrollera vilken art som drabbats oxidation;
3: e steget: bestämma variationen av NOX arten som har genomgått oxidation;
4: e steget: multiplicera variationen i det tredje steget med antalet atomer hos den oxiderande arten;
5: e steget: kontrollera vilken art som drabbats minskning;
6: e steget: bestäm NOX-variationen för de arter som genomgick reduktion;
7: e steget: multiplicera variationen som finns i det tredje steget med antalet atomer av arten som den reducerar;
8: e steget: använd värdet som hittades i det fjärde steget som koefficienten för arten som minskar;
9: e steget: använd värdet som hittades i det sjunde steget som koefficienten för den oxiderande arten;
10: e steget: placera koefficienterna i den andra arten, enligt metoden för provbalansering. I de arter där det inte är möjligt att göra detta, sätt okända som koefficienter;
11: e steget: multiplicera koefficienten för varje art med dess belastning;
12: e steget: Jämna summan av laddningarna av reaktanter med den för produkter för att hitta koefficienten för en av arterna med okända;
13: e steget: slutföra balanseringen med testmetoden.
För att underlätta förståelsen, följ steg-för-steg-beskrivningen ovan, i följande exempel på a redoxekvation med joner:

Jonisk ekvation som visar några joner och allmänna laddningsgrupper 0
Första steget: NOX för varje atom.

NOX av atomer som finns i ekvationen
Andra steget: Arter som genomgår oxidation.

Arter som genomgår oxidation i ekvationen
Eftersom NOX av jod ökar från -1 till 0 från reaktant till produkt är det därför arten som genomgår oxidation.
3: e steget: Bestäm NOX-variationen för den oxiderade arten.
För att göra detta, dra bara av högsta NOX med lägsta NOX:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
Steg 4: NOX multiplicering med kvantitet.
I detta steg multiplicerar vi variationen som finns i det tredje steget med antalet atomer av arten.
Jag- = ∆NOX.1
Jag- = 1.1
Jag- = 1
5: e steget: Arter som genomgår minskning.

Arter som lider av minskning av ekvationen
Eftersom krom NOX minskar från +7 till +3 från reaktant till produkt är det därför arten som genomgår reduktionen.
6: e steget: Bestäm NOX-variationen för den reducerade arten.
För att göra detta, dra bara av högsta NOX med lägsta NOX:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7: e steget: NOX multiplicering med kvantitet.
I detta steg multiplicerar vi variationen som finns i det sjätte steget med antalet atomer av arten.
Cr2O72- = ∆NOX.1
Cr2O72- = 3.2
Cr2O72- = 6
8: e steget: Börja balansera.
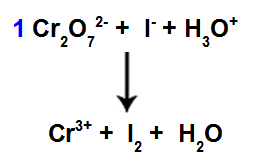
Start av balansering med hittad koefficient
I detta steg startar vi balanseringen genom att placera koefficienten som hittades i det fjärde steget i de arter som drabbades av minskning.
9: e steget: Fortsätt balansera.

Fortsättning av balansering med den hittade koefficienten
10: e steget: Använd testmetoden.
Det finns 6 atomer av I i reaktanten, så vi måste sätta koefficienten 3 i arten I.2 av produkten, eftersom det bara finns 2 Cl-atomer i den;
Som i art 1, Cr2O72-, det finns 2 Cr-atomer, vi bör sätta koefficienten 2 i Cr-arten3+ av produkten.
Eftersom vi har syre i tre arter, och i två av dem finns inga koefficienter, för att fortsätta balansen måste vi placera okända hos de återstående arterna:
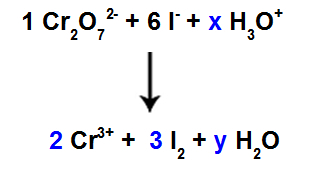
Koefficienter efter testmetoden
11: e steget: Multiplikation av varje art med sin belastning.
För att göra detta multiplicerar du bara artens koefficient med sin belastning enligt följande:
I reagenserna:
Cr2O72- = 1.(-2) = -2
Jag- = 6.(-1) = -6
H3O+ = x. (+ 1) = + x
På produkterna:
Cr3+ = 2.(+3) = +6
Jag2 = 4.0 = 0
H2O = y.0 = 0
12: e steget: Summan av avgifterna.
I det här steget måste vi lägga till de mängder reagenser och produkter som finns i steg 11:
Reagenser = produkter
-2 + (-8) + (+ x) = +6 + 0 + 0
-2 - 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13: e steget: Balanseringens slut.
För att slutföra balanseringen måste vi:
Sätt resultatet i det 12: e steget i art H3O+;
Eftersom vi nu har 42 H-atomer i reagenset är det nödvändigt att placera koefficienten 21 i H-arten2Den i produkten.
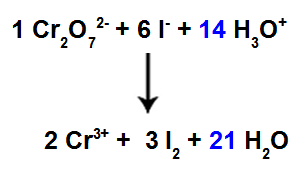
Balanserad jonisk reaktionsekvation
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm

