De allra flesta material som finns i naturen, i vårt samhälle och i våra kroppar är inte rena ämnen, utan faktiskt blandningar av två eller fler ämnen.
Även om vi oftast bara hänvisar till mineralvatten som "vatten" innehåller det i själva verket inte bara den rena substansen H2O, för det är resultatet av en process där regnvatten tränger igenom jorden och passerar genom olika stenar.
Så som namnet antyder har den förutom vatten också flera upplösta mineraler. Om du är nyfiken på att kontrollera etiketten på något mineralvatten ser du att det har sin sammansättning kemi strontiumsulfater, kalcium, natrium, kalium, natriumbikarbonat, natriumfluorid, bland andra.
Mind Map: Blandningar
* För att ladda ner mind map i PDF, Klicka här!
Hur är det möjligt att skilja ett ämne från en blandning?
Det destillerade vattnet som visas nedan är en ren substans som endast innehåller H2O:

Destillerat vatten som används i laboratorium
Visuellt ser det ut som en blandning av vatten och salt; emellertid kan de särskiljas från blandningsdefinitionen. Se:
→ Blandningar är material vars fysiska egenskaper inte är konstanta, men varierar vid en viss temperatur och ett visst tryck.
Så, bara mäta fysikaliska egenskaper, såsom smält- och kokpunkter och densitet. Om de är konstanta och väldefinierade är det a rent ämne (när det gäller destillerat vatten, vid 4 ° C, är densiteten 1,0 g / cm3 och vid havsnivå är smält- och kokpunkterna 0 ° C respektive 100 ° C).
Men om variationer presenteras är det en blandning. Om du värmer vatten-saltblandningen för att kontrollera kokpunkten, kommer du att se att under övergången från flytande tillstånd till gas, förblir temperaturen inte konstant, som med destillerat vatten, som förblir vid 100 ° C tills all vätska roterar ånga.
Nu finns det blandningar att det inte ens är nödvändigt att bestämma deras fysiska egenskaper för att veta att de är blandningar, se bara, som är fallet med följande blandning av vatten och olja:

Blandning bildad av vatten och olja
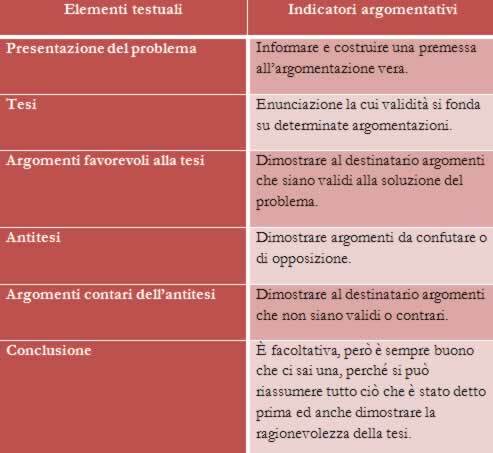
Detta indikerar att det finns olika typer av blandningar som kan klassificeras i homogen och heterogen. Se var och en:
Homogena blandningar:
De är de som har ett enhetligt utseende, med en enda fas (en fas). Exempel:
saltlösning (0,9 g natriumklorid i 100 ml vatten);
saltlösning (36 g salter såsom natriumklorid, magnesiumklorid, kaliumjodat, anti-fuktighetsbevarande medel och 100 ml vatten);
hydratiserad alkohol (etanol och vatten);
luft (78% kvävgas, 20% syrgas, 2% andra gaser och vattenånga);
stål (metalllegering bildad av 98,5% järn och 1,5% kol).

Saltlösning, stål och formaldehyd, exempel på homogena blandningar
Exemplen ovan visar det homogena blandningar de kan vara i fast, flytande eller gasformigt tillstånd. Dessa homogena blandningar kallas lösningar och de kan inte separeras med fysiska metoder, utan endast genom kemiska tekniker. För att exempelvis separera alkohol från vatten är det nödvändigt att genomföra en process av destillering, eftersom en centrifug eller filtrering det skulle inte göra.
Dessutom är det viktigt att betona att de måste vara det homogen även när man tittar under ett ultramikroskop. För blotta ögat kan mjölk och blod till exempel verka homogena, men under ultramikroskopet ser vi att de faktiskt är heterogen. Se bilden av blodet under ultramikroskopet och dess separata faser efter att det har placerats i en ultracentrifug:
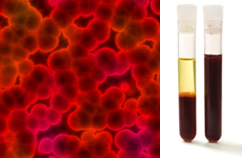
Mikroskopisk bild och blodfaser
Heterogena blandningar:
Är de som har mer än en fas. Exempel: vatten och olja, vatten och sand, is och vatten, granit, vatten och järn, olöst salt i vatten etc.
Komponenterna i heterogena blandningar de förekommer i de flesta fall i olika fysiska tillstånd och kan separeras med fysiska metoder. Ett exempel inträffar när vi gör kaffe och filtrerar det fasta ämnet och separerar det från vätskan.
Men detta händer inte alltid, vilket visas i fallet med olja och vatten, som, trots att de är båda vätskor, inte löser sig på grund av olika dess molekylers polariteter.
Mental karta Av mor Victor Ricardo Ferreira
Kemilärare
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/tipos-misturas.htm