aktiva isomerer eller optiskt aktiva isomerer (IOA) är molekyler av en viss kemisk substans som kan utföra polarisationen och avvikelsen hos plan för ljus höger eller vänster. För att kontrollera om ett ämne har aktiva isomerer eller inte, kolla bara om det finns ett asymmetriskt kol i dess strukturformel:

Genom att analysera kedjan som visas i bilden ovan kan vi se att centralt kol har fyra olika ligander (OH, H, CH3 och Cl), vilket gör det till en kol asymmetrisk, även kallat kol kiral. Således, närhelst en kedja har ett eller flera kirala kol, kommer det att finnas aktiva isomerer.
Du typer av aktiva isomerer(IOA) dom är:
Högerhänt: Aktiv optisk isomer som böjer polariserat ljus till höger;
Levogiro: Aktiv optisk isomer som böjer polariserat ljus åt vänster.
Observation: Närvaron av asymmetriskt kol i en strukturformel indikerar att ämnet måste ha den levoroterande isomeren och den dextrorotatoriska isomeren. Det är inte upp till oss att veta på vilket sätt ljuset avböjdes, eftersom närvaron av det kirala kolet redan bevisar detta. Alltid hälften av de befintliga molekylerna är vänsterhänta och den andra hälften är högerhänta.
Vänsterhänt och högerhänt molekyler av alla organiska ämnen har alltid samma fysiska egenskaper (punkt smältpunkt, kokpunkt, densitet, löslighet etc.), men nuvarande kemiska aktiviteter (beteende i organismen) många olika. Ett exempel är adrenalin. Endast adrenalin levogyra-molekylen verkar i kroppen, medan dextrogyra inte gör det.
Se nu strukturformeln för butan-2-olämnet för att kontrollera om den har aktiva isomerer eller inte:
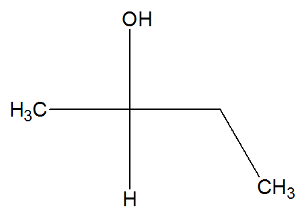
Vi kan observera, i strukturen av butan-2-ol, att kol 2 har fyra olika bindemedel (OH, H, CH3CH2-CH3), så det är ett kiralt kol och presenterar en dextroroterande aktiv isomer och en annan levorotär aktiv isomer.
Beräkning av aktiva isomerer (IOA)
Den holländska kemisten Jacobus Henricus van't Hoff utvecklat en formel som gör det möjligt att beräkna hur många aktiva isomerer (IOA) ett givet ämne kan presentera. Se:
IOA: 2Nej
n: är antalet kirala kolämnen i ämnets strukturformel.
Följ två exempel på tillämpning av Vant't Hoff-formeln:
5-diklor-2,3-dihydroxi-hexandiosyra

I föreningens strukturformel finns det tre kirala kol eller asymmetrisk, därför:
IOA = 2Nej
IOA = 23
IOA = 8
2,3,4,5-tetrahydroxihexanal

I föreningens strukturformel finns det fyra kirala kol (röda pilar) eller asymmetrisk, därför:
IOA = 2Nej
IOA = 24
IOA = 16
Observation: Det finns en möjlighet att en strukturformel har två asymmetriska kol som har exakt samma ligander. Om detta inträffar beaktar vi i beräkningarna endast 1 för värdet n, inte 2. Se ett exempel:
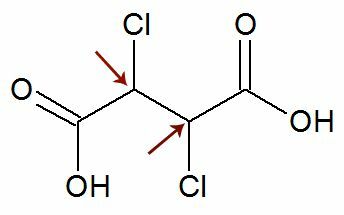
Tycka om två kirala kol dom är är lika med, vi anser bara en kol i beräkningen:
IOA = 2Nej
IOA = 21
IOA = 2
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm