Om vi använder en voltmeter i ett batteri kommer vi att kunna identifiera skillnaden i potential (U eller ddp) eller elektromotorisk kraft (emf eller E) mellan de två elektroderna. Det är emellertid inte möjligt att identifiera reduktions- eller oxidationspotentialerna för varje elektrod på detta sätt.
Forskare behövde känna till dessa värden för att studera processer för oxidationsreduktion, så de etablerade en referensläge. Detta innebär att man enades om att mäta potentialen för varje elektrod i förhållande till en annan elektrod under följande standardförhållanden:
• Temperaturen måste vara vid 25 ° C;
• Tryck vid 1,0 atm;
• Koncentrationen av lösningen i vilken metallen nedsänks måste vara 1,0 mol / L.
Således var den valda elektroden den väteelektrod, som visas nedan:
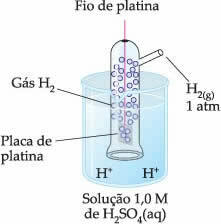
Denna elektrod består av en platinatråd ansluten till en platinaplatta, som inte deltar i reaktionen, inuti ett rör som innehåller vätgas och nedsänkt i en sur lösning. I exemplet var lösningen svavelsyra.
| Enligt konvention har standardvätelektroden tilldelats värdet noll-, så mycket för E0röd vad gäller E0oxi. |
Så för att hitta det potentiella värdet av någon annan elektrod bygger vi bara en stapel av den elektrod vi vill ha med standardväteelektroden och mäter ddp med en voltmeter. Värdet som visas på voltmätaren kommer att vara potentialen för den sökte elektroden, eftersom det för väte är lika med noll.
Till exempel förbinder vi en zinkelektrod med vätelektroden för att ta reda på vilken reduktionspotential den har:
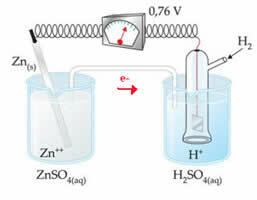
Enligt ovanstående schema identifierade voltmätaren potentialskillnaden som lika med +0,76 (? E0 = +0,76). Vi noterar också att zinkelektroden har oxiderat, så det är anoden; och väteelektroden reducerades, eftersom den var katoden.
Så vi har:
? E0 = E0red (katod) - E0 röd (anod)
0,76 = 0,00 - E0 röd (Zn)
E0 röd (Zn) = 0,00-0,76
E0 röd (Zn) = -0,76
Det negativa värdet betyder att elektronströmmen flyter från zinkelektroden (anoden) till vätelektroden och uppför sig sålunda som en katod. Om det var positivt skulle det vara tvärtom och väteelektroden skulle bete sig som en anod. Detta kan ses när vi förbinder en kopparelektrod med standardväteelektroden:
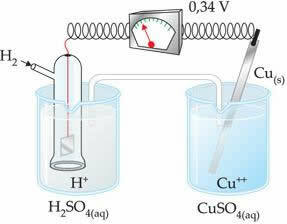
? E0 = E0red (katod) - E0 röd (anod)
-0,34 = 0,00 - E0 röd (Zn)
E0 röd (Zn) = 0,00 + 0,34
E0 röd (Zn) = +0,34
Det är sålunda möjligt att definiera reduktions- och oxidationspotentialerna för de mest varierade kemiska arterna. International Union of Pure and Applied Chemistry (IUPAC) rekommenderar dock att man endast använder reduktionspotentialer. Och oavsett vilken metall som används, i batterirepresentationen kommer väteelektroden alltid först, till exempel:
Pt - H2 (g) 1 atm / H3O1 + (aq) 1 mol / L // Cu2 + (aq) 1 mol / L / Cu
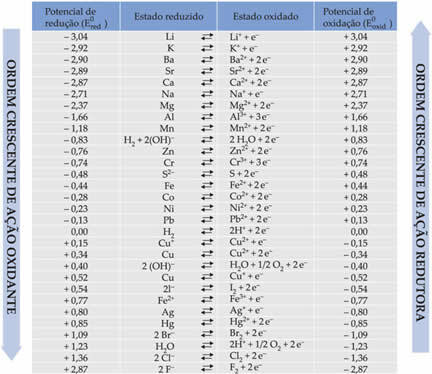
Nedan listas i tabellen de potentialer som uppnås genom denna metod för användning av standardväteelektroden, tillsammans med deras respektive halvreaktioner:
Av Jennifer Fogaça
Examen i kemi
Brasilien skollag
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm
