I laboratorier och kemisk industri är det mycket viktigt att veta mängden ämnen som är inblandade i reaktionerna. Nedan kommer vi därför att behandla huvudkoncepten, kvantiteterna och måttenheterna relaterade till atommassorna:
- Atomic Mass Unit (u):
Standardviktsreferensatomen för att beteckna atommasseenheten är kol-12 (12Ç). En atommasseenhet (1 u) motsvarar värdet 1.66054. 10-24 g, vilket är massan av 1/12 av kolisotopen med en massa lika med 12 (12Ç).
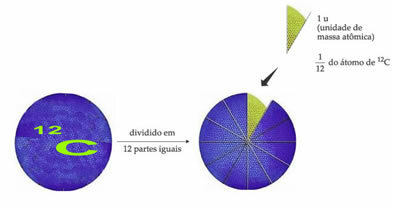
Atommasseenheten (u) är den enhet som används i alla kvantiteter som anges nedan.
- Atomic Mass of an Atom or Isotope (MA):
Det erhålls genom att jämföra det med referensvärdet som nämns i föregående objekt. Till exempel, atommassan av 919F ges av masspektrometern, som är lika med 18,9984 u. Avrundning är lika med 19, vilket är samma värde som dess massnummer (A). Detta värde betyder att elementets atommassa 919F är 19 gånger större än massan av 1/12 av 12Ç.
- Atomic Mass of an Element (AM):
Elementets atommassa bestäms av det viktade genomsnittet av atommassorna för dess isotoper. Detta görs genom att multiplicera atommassorna för varje isotop med den procentsats som visas i elementets konstitution. Dessa värden läggs sedan till, som divideras med 100, vilket resulterar i den totala procentandelen.
Elementet neon består till exempel av tre isotoper med följande atommassor och procentsatser i deras konstitution:

Beräkning av atommassan (MA) för detta element:
DÅLIGneon = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
DÅLIGneon = 20 179 u
- Molekylär massa (MM):
Som namnet antyder används det för molekylära ämnen, det vill säga atomer kopplade genom en delning av elektronpar, som kallas kovalenta bindningar.
Molekylmassa erhålls genom att multiplicera antalet atomer för varje element med deras atommassor och lägga till resultaten.
Till exempel CO-molekylen2 innehåller ett kol och två oxygener, så vi multiplicerar atommassan av kol med 1; och syre med två, lägga till dem senare:
MMCO2 = (1. DÅLIGÇ) + (2. DÅLIGO)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Massformel:
Det är samma beräkning som utförs för molekylvikt, dock för jonföreningar. I det här fallet är namnet annorlunda eftersom de inte är grupperade i molekyler utan i kluster av joner. Eftersom molekyler inte existerar finns det uppenbarligen ingen mening att prata om molekylär massa, men resonemanget bakom beräkningen är detsamma.
Exempel:
NaCl
↓ ↓
23 +35,5 → Formelmassa = 58,5 u
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm

