DE salthydrolys mellan starka syror och baser det inträffar när katjonen i ett salt inte interagerar med anjonen i vatten, och anjonen i saltet inte interagerar med katjonen i vatten. Hydrolys mellan katjoner och anjoner av ett salt och vatten sker endast när den bildade produkten är en svag syra, en svag bas eller båda. Förstå salthydrolysen mellan starka syror och starka baser steg för steg:
a) Steg 1: vattenjonisering
Vatten är ett ämne som har förmågan att lida autojoniseringdet vill säga det producerar hydroniumkatjon (H+och hydroxidanjon (OH-) från dess struktur.
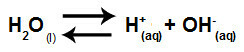
Ekvation som representerar självjonisering av vatten
b) Steg 2: Dissociation salt
När ett salt tillsätts till vatten, går det igenom dissociationsprocessen. Eftersom salt är en jonförening släpps dess katjoner och anjoner i vatten i mediet, såsom i ekvationen som visas nedan:
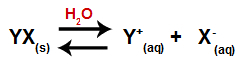
Ekvation som representerar dissociationen av något salt
c) Steg 3: Salthydrolys av starka syror och baser
För stark syra: när anjonen av saltet kombineras med H
+ vatten för att bilda HCl, HBr, HI eller en annan syra i vilken subtraheringen av antalet oxigener med antalet väten är lika med eller större än 2, kommer vi att ha en stark syra. Därför förekommer inte kombinationen mellan de nämnda jonerna.För stark grund: när katjonen av saltet som tillhör IA (alkalimetaller) eller IIA (andra jordalkalimetaller än magnesium) kombineras med OH- vatten kommer det att bilda en stark grund. Därför förekommer inte kombinationen mellan de nämnda jonerna.
När saltjoner inte interagerar med vattenjoner har vi följande ekvation:
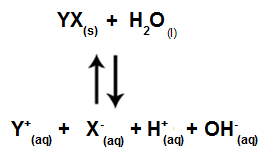
Ekvation som visar alla joner som finns i lösningen
Sammanfattningsvis, eftersom saltjoner inte interagerar med vattenjonerna, främjar inte saltjonerna någon förändring i den slutliga lösningen. Således kan vi skriva ekvationen av en salthydrolys mellan starka syror och starka baser precis med vattenjoniseringsekvationen.
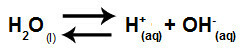
Ekvation som representerar hydrolys av starka syror och baser
d) Exempel på salthydrolys mellan starka syror och baser
När vi tillsätter kaliumkloratsaltet till vatten (KClO3saltet dissocieras och frigör kaliumkatjonen (K+och kloranjonen (ClO3-) i mitten.
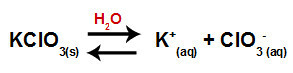
Dissociationsekvation för kaliumklorat
Det är viktigt att komma ihåg att vatten genomgår självjonisering och förser mediet med hydroniumkatjon (H+och hydroxidanjon (OH-). Vi måste nu bedöma samspelet mellan salt och vattenjoner.
När H+ interagerar med ClO3-bildar den perklorsyra (HClO3). Eftersom antalet oxigener subtraheras med antalet joniserbara väten i perklorsyra är det 2, är det starkt. Därför sker inte interaktionen mellan jonerna.
När K-katjonen+ interagerar med OH-anjonen-, har vi bildandet av en stark bas, eftersom kalium är en alkalimetall. Därför sker inte interaktionen mellan jonerna.
Ekvationen som representerar salthydrolysen mellan starka syror och baser från upplösning av kaliumklorat i vatten är:
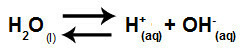
Kemisk ekvation av kaliumklorathydrolys
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm

