Bas är oorganiskt ämne som enligt den svenska kemisten Svante Arrhenius, när den placeras i vatten, lider fenomenet jonisk dissociation, där det finns frisläppande av joner: katjon (Y+och hydroxidanjon (OH-).

Allmän formel för en Arrhenius-bas
Y-gruppen av a bas det kan vara vilken metall som helst eller annan i ammoniumgruppen (NH4+), som frigörs i vatten som katjoner under dissociation, vilket kan ses i ekvationen som representerar processen:
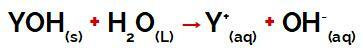
Ekvation som representerar dissociationen av en bas
Se nedan mycket viktig information om klassificering och nomenklatur för baser.
1) Klassificering avseende basernas löslighet(förmåga att att lösa upp i vattnet)
Baser löslig: har alkalimetall eller ammonium i kompositionen;
Baser måttligt lösbar: har jordalkalimetall i komposition. Exempel: magnesiumhydroxid, allmänt använt som ett antacida och laxermedel;
baser praktiskt taget olöslig: har någon annan metall i kompositionen. Exempel: aluminiumhydroxid, allmänt använt som ett antacida.
2) Klassificering avseende gräsrotsstyrka(förmåga att ta avstånd i vattnet)
Baser stark: har alkali- eller jordalkalimetaller, med undantag av magnesium, i kompositionen;
Baser svag: har någon annan metall i kompositionen.
3) Basnomenklatur
För att namnge en bas, följ bara namngivningsregeln nedan:
Hydroxid + de + namn på metall eller ammonium
Exempel: Ca (OH)2 → kalciumhydroxid
Om basen har ett kemiskt grundämne som inte tillhör IA-, IIA- eller IIIA-familjerna (och det är inte silver eller zink), måste vi ange framför elementets namn, i romerska siffror, antalet hydroxyler:
Exempel: Ti (OH)4 → titanhydroxid IV
Av mig, Diogo Lopes
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm


