O atomradie (r) definieras vanligtvis som halva avståndet mellan två kärnor i angränsande atomer, som bilden nedan representerar:

Atom radie
Atomradien skiljer sig från en atom till en annan beroende på dess familj och period på det periodiska systemet. När det gäller element som tillhör a samma familj, dess atomradie ökar när atomantalet ökar., det vill säga från topp till botten. För i den meningen betyder det att från en atom till en annan har en energinivå eller ett elektroniskt skikt ökat, så dess radie ökar proportionellt.
När det gäller elementet under samma period, det vill säga horisontellt, radien ökar från höger till vänster, eller när atomantalet minskar. Detta beror på att de alla har samma antal lager, vad som gör skillnaden är mängden elektroner i dessa lager, och ju fler elektroner, desto större attraktion mot kärnan, vilket minskar radien på atom.

Atomeradius tillväxtriktning enligt familj och period i det periodiska systemet
Atomradien kan dock variera beroende på vilken anslutning som görs. Låt oss se hur detta händer:
* Jonisk obligation: Om atomen bildar en kation, kommer atomradien att minska, eftersom att förlora en eller flera elektroner kommer kärnan att locka elektronerna mer intensivt. Nu om bilda en anjon, dvs få elektroner, kommer atomens radie att öka, eftersom den totala laddningen för elektrosfären kommer att vara större än den totala laddningen för kärnan, vilket minskar dess attraktion. Ju fler elektroner du vinner eller tappar, desto större blir variationen i strålens storlek.
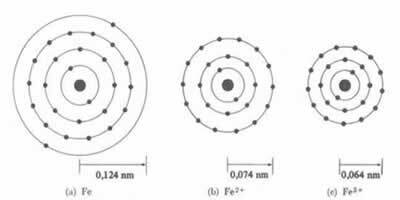
Katjonens diameter eller radie är alltid mindre än atomens diameter eller radie
Också i en serie av isoelektroniska joner, som har samma mängd elektroner och energinivåer, kommer jonen med det minsta atomantalet att ha en större radie. Till exempel jonerna 13Al3+, 12mg2+, 11På1+, 9F-1, 8O2- och 7N-3, alla har 10 elektroner och 2 elektroniska nivåer. Men vad som har den största radien är 7N-3, eftersom det har det minsta atomnummeret (Z = 7).
*Kovalent bindning: När två atomer bildar en kovalent bindning, om de två atomerna är lika, som i fallet med vätgas (H2), man kan tala om en kovalent radie (r), som är halva längden på bindningen (d), det vill säga halva avståndet som skiljer de två kärnorna. Fastän, om bindningen är gjord av olika atomer, som i fallet med väteklorid (HCl), längden eller avståndet (d) kommer att vara summan av de kovalenta radierna (r1 + r2) av de atomer som är involverade i kovalensen.
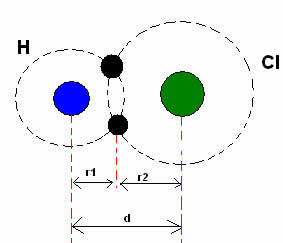
Summan av atomradier i en kovalent bindning.
Naturligtvis måste vi komma ihåg att denna fråga är mycket mer komplicerad, eftersom en atoms kovalenta radie kan variera eftersom den binder till andra olika atomer.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm