Vi kommer att se i denna text hur en diagram över förändring av fysiskt tillstånd till någon rent ämne, hur man tolkar denna typ av diagram och hur blandningsdiagrammet representeras.
För att göra detta, låt oss överväga exemplet med vatten. Tänk dig att vi tar ett glas is vid en temperatur av –10 ºC och startar en uppvärmningsprocess under ett tryck på 1 atm. När temperaturen ökar, från -10 ° C till -9 ° C, till -8 ° C och så vidare, kommer isen att förbli i fast tillstånd tills den når en temperatur på 0 ° C.
Vid den tidpunkten börjar den flytta till flytande tillstånd, det vill säga fusion börjar äga rum. Temperaturen fortsätter inte att öka som tidigare, men kommer att förbli konstant vid 0 ° C tills all is har smält:

Efter att ha smält allt fast ämne fortsätter systemets temperatur att öka tills det når en temperatur på 100 ° C. Vid denna temperatur börjar vattnet som var i flytande tillstånd att förändras till ångtillstånd, det vill säga det kokar.
Precis som det hände i fusionspunktvid kokpunkten kommer temperaturen också att förbli konstant tills all vätska förvandlas till ånga. Därefter fortsätter temperaturen att stiga om vi fortsätter att värma systemet:
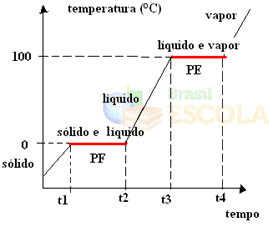
Redo! Detta är diagrammet eller diagrammet som representerar förändringen i vattnets fysiska tillstånd eller dess värmekurva. Om det vore den omvända processen skulle vi ha följande vattenkylningskurva:
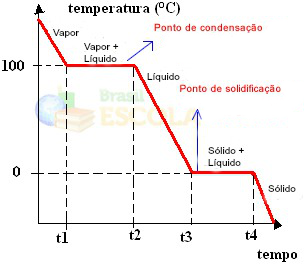
En mycket viktig aspekt av dessa diagram är att de bildas av två nivåer, det vill säga det finns två punkter där temperaturen förblir konstant ett tag. Detta sker alltid vid förändring av tillståndet för en ren substans. Den enda skillnaden är smält- och kokpunktvärdena.
Syre, till exempel till skillnad från vatten, är inte en vätska utan en gas vid rumstemperatur (cirka 20 ºC). Detta beror på att dess smältpunkt vid havsnivån är -223,0 ° C och dess kokpunkt är -183,0 ° C. Se ditt diagram för förändring av fysiskt tillstånd:

Vanlig blandningsgrafik
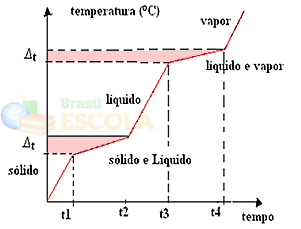
Om vi värmer eller kyler en blandning kommer smältpunkten och kokpunkten inte att ha bestämda och konstanta värden, det vill säga de två nivåerna som observeras i graferna kommer inte att bildas ovan.
Förändringar i fysiska tillstånd kommer att ske över temperaturintervall snarare än en fast mängd. Smältpunkten, till exempel, börjar vid en given temperatur och slutar vid en annan, och detsamma kommer att hända med kokpunkten, som visas i diagrammet nedan:
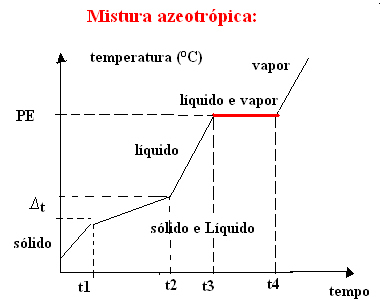
Två undantag är eutektiska och azeotropa blandningar. Se vad som händer med dem:
a) Eutektisk blandning
Den eutektiska blandningen beter sig som om den vore en ren substans under fusionen, det vill säga vid den tidpunkten förblir temperaturen konstant från början till slutet av förändringen av aggregationstillståndet.

b) azeotropisk blandning
Den azeotropa blandningen beter sig som en ren substans under kokning, det vill säga vid denna tidpunkt förblir temperaturen konstant från början till slutet av förändringen i aggregeringstillstånd.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/graficos-mudanca-estado-fisico.htm
