DE oktettteori föreslogs av Newton Lewis, som i studier observerade att atominteraktion händer så att varje element förvärvar den elektroniska stabiliteten hos en ädelgas, det vill säga åtta elektroner i valenslager. I vissa molekyler händer emellertid det som kallas en expansion eller kontraktion av oktetten, det vill säga den centrala atomen etablerar mer eller mindre förutsagda bindningar.
Läs också: Kovalent bindning - klassificeringar och egenskaper
Hur fungerar oktettteori?
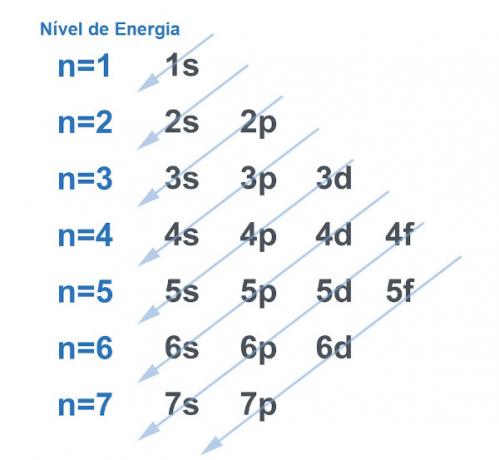
Naturligtvis tenderar alla system att leta efter ett sätt att förvärva så mycket stabilitet som möjligtoch detta skiljer sig inte åt med atomen. Atomer är "baspartiklar" av alla ämnen och var och en har en elektrosfär i sin struktur. Denna elektrosfär delades med Linus Pauling i energinivåer och undernivåer. Pauling utvecklade ett diagram för att visa hur fördelningen av elektroner runt en atoms kärna skulle se ut.
Se bilden nedan:

Varje nivå och delnivå rymmer ett belopp på elektroner
. Genom att göra en analogi kan vi säga att varje nivå är en hylla, och varje undernivå är en låda. I varje låda, montera två elektroner. Atomen är stabil när alla dess elektroner är ihopkopplade, det vill säga när det finns alla lådor med två elektroner vardera.Exempel:
Låt oss göra den elektroniska fördelningen av syre (O), som har åtta elektroner i sitt naturliga tillstånd.

Lägg märke till att vi i valensskiktet (L-lagret, i p-undernivå) har två oparade elektroner. Det är dessa elektroner som skapar kemiska bindningar med andra element vill skapa elektroniska par.
Oktettteori bygger på matematiken för summering av elektroner. Om alla undernivåer i det sista elektronskalet har två elektroner vardera, kommer valensskalet att ha totalt åtta elektroner och följaktligen kommer atomen att vara stabil.
Läs också: Kvantnummer - tal associerade med elektronens energimängd
ädelgaser
Ädelgaser är de enda elementen som finns i naturen i monoatomisk formutan att upprätta ett band med en annan atom. Detta beror på att de har elektronisk stabilitet. Nästan alla har åtta elektroner i valensskalet., som följer oktettregeln, med undantag av heliumgas, som bara har två elektroner.

Undantag från oktetteorin
Vissa föreningar lyckas stabilisera sig med mer eller mindre än åtta elektroner i valensskalet. I dessa fall förekommer undantag från oktettteorin.
oktett expansion
Det händer främst med fosfor (P) och svavel (S), som är relativt stora atomer och har "d" undernivå. I det här fallet håller atomen mer än åtta elektroner i sitt sista skal.
Exempel:

När det gäller svavelhexafluorid sattes det centrala elementet kvar med 12 elektroner, överstiger de 8 som krävs för att stabilisera enligt oktetregeln. I det här fallet skedde en expansion av oktetten.
oktettkontraktion
Händer med beryllium (Be), bor (B) och något oxider kväve. Se exemplet:

När det gäller bortrifluorid förvärvar fluoratomerna de nödvändiga åtta elektronerna i valensskalet genom att dela elektronisk med bor, med respekt för oktettregeln, men den centrala atomen (bor) stabiliseras inte med sex elektroner, vilket inträffar ett sammandragning av oktetten.
Också tillgång: Klassificering av en sigma-länk: vad är kriterierna?
Övningar lösta
fråga 1 - (Mackenzie-SP) För att svavel- och kaliumatomer ska få en elektronisk konfiguration som är lika med en ädelgas är det nödvändigt att:
(Data: atomnummer S = 16; K = 19.)
A) svavel tar emot 2 elektroner och kalium tar emot 7 elektroner.
B) svavel ger 6 elektroner och kalium tar emot 7 elektroner.
C) svavel ger 2 elektroner och kalium ger 1 elektron.
D) svavel tar emot 6 elektroner och kalium ger upp 1 elektron.
E) svavel tar emot 2 elektroner och kalium ger upp 1 elektron.
Upplösning
Alternativ E. Svavel är ett element i kolumn 16 eller familj 6A. Elementen i denna familj tenderar att ta emot två elektroner för att bilda elektroniska par och har totalt åtta elektroner i valensskalet. Elementen i 1A-familjen, som är alkalimetallerna, har bara en elektron i valensskalet. Genom att donera denna elektron blir det tidigare lagret valenslagret, redan med de åtta elektronerna, som dikteras av oktettregeln.
Fråga 2 - Bedöm följande påståenden som sanna (T) eller falska (F).
I () Oktettregeln säger att åtta elektroner behövs i valensskalet för att atomen ska vara stabil.
II () Valensskiktet är atomens andra elektroniska lager.
III () Klor (Cl), från halogenfamiljen, tenderar att få två elektroner för att få stabilitet.
IV () Sodium (Na), ett element i familjen 1A, tenderar att förlora den enda elektronen i sitt valensskal.
Markera rätt alternativ:
A) I, III och IV är sanna.
B) I och IV är sanna.
C) Endast II är sant.
D) Endast IV är falsk.
E) Alla är sanna.
Upplösning
Alternativ B. Jag och IV är sanna. Uttalande II är felaktigt, eftersom valensskiktet är det sista elektroniska lagret i atomen, inte det andra. Och uttalande III säger att klor tenderar att få två elektroner, vilket inte kontrollerar eftersom klor är från 7A- eller 17-familjen tenderar att bara vinna en elektron för att därmed förvärva den elektroniska konfigurationen av en gas ädel.
Av Laysa Bernardes Marques de Araújo
Kemilärare