Hybridiseringsteorin framkom som ett komplement till Oktettteori, lyckas förklara strukturen för ett större antal molekyler, inklusive molekyler bildade av bor (B).
Detta element har fem jordtillståndselektroner, med följande elektronkonfiguration:
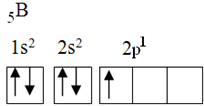
Enligt oktettteorin kunde bor bara göra en kovalent bindning, eftersom den bara har en ofullständig atombana. Experimentellt noteras dock att detta element bildar föreningar i vilka det utför mer än en bindning.
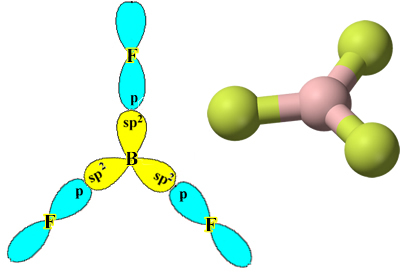
Ett exempel är bortrifluorid (BF3). Som visas nedan gör bor tre kovalenta bindningar med fluor och delar tre par av elektroner och med sex elektroner i sitt sista skal (valenslager), det vill säga ett undantag från regeln om oktett.
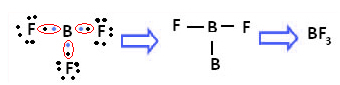
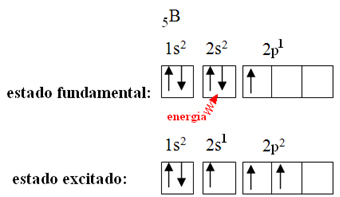
Detta förklaras av hybridiseringsfenomenet som förekommer med bor. Det visar sig att en elektron från undernivå 2 absorberar energi och går in i det exciterade tillståndet, där den hoppar in i en tom omloppsnivå av undernivå 2p. Således bildas tre ofullständiga orbitaler, som nu kan skapa tre kovalenta bindningar:
Bindningarna som bildas i bortrifluorid är emellertid desamma, men om vi ser ovan finns det två bindningar annorlunda, eftersom en av dem skulle göras genom en s orbital och de andra två genom en orbital av typen. typ p. Det är här hybridiseringen sker, det vill säga de ofullständiga orbitalerna smälter samman, vilket ger upphov till tre hybridorbitaler eller hybridiserad, som är identiska och skiljer sig från originalen:
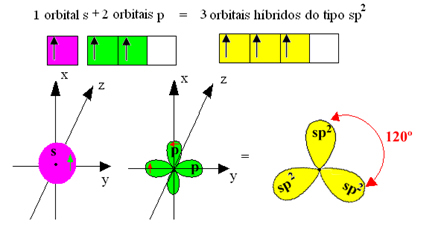
Eftersom dessa hybridorbitaler består av en s orbital och två p orbitaler kallas denna hybridisering sp² hybridisering.
Fluor som binder till bor har nio elektroner. Dess elektroniska distribution och orbitaler visas nedan:
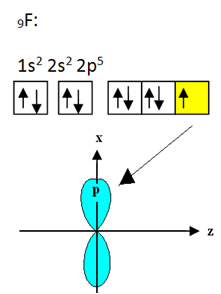
Observera att varje fluoratom endast kan bilda en kovalent bindning och att banan som gör denna bindning är av typ p. Så observera nedan hur orbitalerna bildas när du gör de anslutningar som bildar BF3 och se hur länkarna är identiska σp-sp2:
Detta händer också med andra element, se till exempel texten ”Beryllium hybridisering”.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm

