DEosmos och den lösningsmedelspassage, från en mindre koncentrerad lösning till en mer koncentrerad lösning, genom en semipermeabelt membrantills det tryck som utövas av lösningen på membranet förhindrar passage av lösningsmedel. Denna process är avsedd att balansera koncentrationen av lösningen.
Läs också: Lösningsmedel och lösningsmedel
osmotiskt tryck
DE osmotiskt tryck och den tryck utövas på lösningen med större koncentration så att osmos inte uppträder, det vill säga så att lösningsmedlet inte passerar det halvpermeabla membranet.
Osmotiskt tryck används i processer av avsaltning av vatten, tvingar processen för omvänd osmosoch får lösningsmedlet att passera från den mer koncentrerade lösningen till den mindre koncentrerade. Vi kallar den här processen omvänd osmos. Se följande bild som jämför de två processerna:
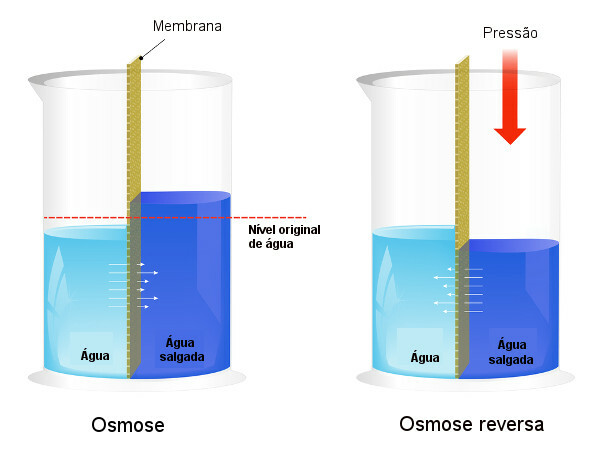
Observera att i osmos är lösningen av lösningsmedel i riktning mot den mest koncentrerade lösningen och att, i omvänd osmos, är passagen i motsatt riktning på grund av det applicerade trycket. För att lära dig mer om ämnet, läs vår text:
osmotiskt tryck.veta mer: Omvänd osmos vid avsaltning av havsvatten
osmotisk tryckekvation
Osmotiskt tryck, representerat av bokstaven pi (π) av en lösning, kan beräknas med följande ekvation:
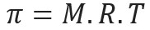
M = koncentration i mol / L.
R = universalkonstant av perfekta gaser
T = absolut temperatur, i K
som andra kolligativa egenskaper, beror det osmotiska trycket på lösningskoncentration, det vill säga ju större koncentrationen av lösningen är, desto större är effekten av osmos på lösningarna och därför desto större är det osmotiska trycket.
Exempel
Osmos uppträder i våra dagliga liv vid olika tidpunkter. Vi kan nämna exemplet med saltningsprocess till din bevarande. Du mikroorganismer som skulle orsaka köttnedbrytning tappa vattenfrån insidan till utsidan, som har en koncentration av salt, vilket gör att maten håller längre.
På grund av saltet händer det också att salladsblad vissnar för att ha förlorat vatten från insidan av deras celler (typ av mindre koncentrerad) för härdad lösning i den yttre miljön.
Osmos är också viktigt när vi pratar om blod mänsklig. Vi säger att Röda celler och blodet är ett isotoniskt medium, det vill säga de har samma osmotiska tryck, vilket gör det lätt att komma in och ut ur vattnet från cellen.
Men när blodet blir mindre koncentrerat än inuti de röda blodkropparna (hypotoniskt medium) kommer vattenpassagen att ske lättare inuti cellen, vilket gör det svälla tills det spricker. Om blodet når en koncentration som är större än koncentrationen av de röda blodkropparna (hypertoniskt medium), blodceller vissnar, eftersom de tappar vatten.

Enligt samma princip för att bevara kött, fruktbevarandei godiskompottarna, som konserverar mat på grund av hög sockerkoncentration i lösningen.
Följande är andra exempel där osmos uppträder:
- i ökningen av saft i anläggningens ledande fartyg;
- kl hemodialys;
- vid selektiv passage av näringsämnen i cellerna i människokroppen.
För att förstå hur osmos händer i djurcellen, växtcellen och andra biologiska problem, läs: Osmos: vad det är och hur det förekommer i djur- och växtcellen.
Av Victor Ferreira
Kemilärare

