Elementen i familj 17 eller VII A i det periodiska systemet kallas halogener, representerade av de fem elementen som listas nedan: Fluor (F), klor (Cl), brom (Br), jod (I) och astatin (At). De representeras ofta generiskt av bokstaven X.

De viktigaste, på grund av deras dagliga applikationer, är klor, brom och jod.
Detta namn "halogen" betyder "saltbildning".
Alla har 7 elektroner i valensskalet (elektroniskt skal längst ner till kärnan och mer energiskt). Generellt: ns2 np5. Som ett resultat tenderar de att ta emot en elektron och bilda negativa monovalenta joner (X-1), som huvudsakligen reagerar med alkalimetaller (familj 1-metaller), som tenderar att donera en elektron. Således ger de upphov till föreningar med formler av MX-typen.

Genom att få denna elektron är halogenerna stabila, eftersom deras valensskal är komplett (med åtta elektroner) och deras egenskaper förändras helt. Till exempel klorgas (Cl2) är en gröngul, tät, mycket giftig och reaktiv gas, lite löslig i vatten och reagerar explosivt med väte. Men när
klor (Cl) tar emot en elektron från natrium (Na), de blir joner och bildar natriumklorid (NaCl) eller bordssalt, som vi tar in dagligen och som är nödvändiga för att upprätthålla våra liv. Klor blir särskilt kloridjonen (Cl-) som är nödvändig i vår kropp för bildandet av saltsyra (HCl), huvudkomponenten i vår magsaft.Faktum är att klor är den vanligaste av halogenerna och används vid framställning av organiska föreningar, oorganiska ämnen, vid papperstillverkning (med sikte på blekning av massa) och i vatten och avlopp. Det är också vanligt att använda en vattenlösning av natriumhypoklorit (NaClO), som kallas "flytande klor" och som består av blekmedel.
Ett intressant faktum är att även om vissa säger att ”fast klor” används i simbassänger är det faktiskt inte bara grundämnet klor utan kalciumhypoklorit (Ca (ClO)2).
Ett liknande fall är också användningen av fluor - som faktiskt inte är fluor i sig utan fluorider (jonföreningar som innehåller grundämnet fluor) - vid dricksvattenbehandling och i munvårdsprodukter.
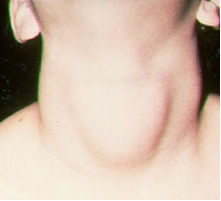
Med hänsyn till jod, är en viktig tillämpning deras tillsats (i form av jodider eller natrium- och kaliumjodater), som krävs enligt lag, till bordssalt. Detta beror på att bristen på jod i kroppen kan orsaka en sjukdom som kallas struma, populärt kallad papo.
O brom det är en röd vätska, vid rumstemperatur, tät och instabil och eftersom den är flyktig kan den avdunsta och bilda en rödaktig ånga. Det finns inte i naturen isolerat och används inte heller i industrin på detta sätt. Huvudapplikationerna för dess föreningar är: som katalysatorer för organiska reaktioner blandade med bränslen, bland annat i fotografisk utveckling.
redan den astat det är ett radioaktivt element. Dess ursprung är vanligtvis som ett resultat av radioaktivt sönderfall av uran och toriumisotoper. Den bildar minst 20 isotoper, med At-210 som den mest stabila, med en halveringstid på 8,3 timmar. Det är ett mycket sällsynt element.
Av Jennifer Fogaça
Examen i kemi

